



Artículos
Caracterización microbiológica, sensorial y bromatológica de la fermentación de cacao en los genotipos CCN 51 e ICS 95
Microbiological, sensory and bromatological characterization of cocoa fermentation in ICS 95 and CCN 51 genotypes
Revista FAVE Sección Ciencias Agrarias
Universidad Nacional del Litoral, Argentina
ISSN: 2346-9129
ISSN-e: 2346-9129
Periodicidad: Semestral
vol. 22, e0016, 2023
Recepción: 27 Septiembre 2022
Aprobación: 27 Junio 2023

Resumen: La fermentación del cacao es un proceso clave y relevante en la síntesis de moléculas precursoras de aroma y sabor. El objetivo de este estudio fue la caracterización microbiológica, sensorial y bromatológica de la fermentación de los granos de cacao en los genotipos ICS 95 e CCN51. Se realizó la extracción del grano llevándose a fermentadores semi-escalera durante siete días, tomándose muestras cada 24h para identificación. En laboratorio, se efectuó el aislamiento de los microorganismos e identificación, para levaduras, con la amplificación de la región ITS (Internal Transcribed Spacer) y las bacterias mediante la secuenciación del gen 16S ARN ribosomal. Para el análisis sensorial y bromatológico, se llevó a secado el grano hasta obtener 7% de humedad, identificando el perfil sensorial a partir de licor de cacao, a través de evaluadores entrenados. Se identificaron microorganismos como: Candida orthopsilosis, Hanseniaspora opuntiae, Issatchenkia orientalis, Saccharomyces cerevisiae, Kodamaea ohmeri, Tatumella sp., Tatunella ptyseos, Lysinibacillus, Lactiplantibacillus plantarum, Acetobacter pasteurianus, Acetobacter sp., Gluconobacter sp., Gluconacetobacter sp., Bacillus sp., Bacillus cereus y Serratia marcescens. Como resultado sensorial se determinó que ICS 95 presentó mayores descriptores sensoriales positivos como nuez, frutal y floral en comparación al CCN 51, que refleja sabores básicos más intensos. Por el contrario, en CCN 51 se resaltó en mayor proporción los polifenoles, la teobromina y carbohidratos. Estos resultados serán el punto de partida sobre la potencialidad que brindan los microorganismos en la calidad sensorial, para así mejorar de manera significativa los procesos de fermentación a nivel industrial.
Palabras clave: Microorganismos, fermentación, cacao, genotipos, cosecha.
Abstract: The fermentation of cocoa is a process carried out by microorganisms whose composition and activity is relevant in the synthesis of precursor molecules for flavor and aroma. The objective of this study was to carry out a microbiological, sensory, and bromatological characterization of cocoa beans during the fermentation process in genotypes ICS 95 and CCN 51. For this, cocoa beans were extracted during the fermentation process, taking samples every 24 hours for seven days. In the laboratory, the isolation and identification of the present microorganisms were carried out. Yeasts were identified using amplification of the ITS region (Internal Transcribed Spacer), while bacteria were identified by sequencing the 16S ribosomal RNA gene. Subsequently, cocoa beans were dried to 7% moisture, identifying the sensory profile from prepared cocoa liquor, through trained evaluators. The analyses allowed the identification of microorganisms such as Candida orthopsilosis, Hanseniaspora opuntiae, Issatchenkia orientalis, Saccharomyces cerevisiae, Kodamaea ohmeri, Tatumella sp., Tatunella ptyseos, Lysinibacillus, Lactiplantibacillus plantarum, Acetobacter pasteurianus, Acetobacter sp., Gluconobacter sp., Gluconacetobacter sp., Bacillus sp., Bacillus cereus and Serratia marcescens. Sensory analyses indicated that the ICS 95 genotype presented better descriptors than CCN 51, such as walnut, fruit and floral, reflecting more intense basic flavors. On the contrary, in the CCN 51 genotype, a higher proportion of polyphenols, theobromine, and carbohydrates were detected. These results will allow determining the potential effects of these microorganisms on the sensory quality of cocoa beans, to significantly improve fermentation processes at an industrial level.
Keywords: Microorganisms, fermentation, cocoa, genotypes, harvest.
INTRODUCCIÓN
Los granos de cacao son la materia prima para la formación de productos de chocolatería, sin embargo, este exquisito sabor que emerge de un chocolate se presenta por factores genéticos, agroclimáticos y procesos de postcosecha que intervienen sobre los mismos (Perez et al., 2021). Los granos de cacao sin proceso de fermentación no tienen un sabor tan agradable porque destacan los sabores amargos, ácidos y astringentes, y no se forman precursores de sabor y aroma (Cevallos-Cevallos et al., 2018), por lo que se hace necesario realizar procesos de postcosecha. En los procesos de postcosecha de cacao intervienen una serie de actividades como la selección de fruto, extracción del grano húmedo, fermentación, secado y almacenaje; con una adecuada ejecución de estas actividades se define parte de la calidad final del grano de cacao (Fang et al., 2020; Jaimes-Suárez et al., 2021). En la fermentación de los granos de cacao intervienen un sin número de microorganismos, los cuales son los responsables de que se efectúen cambios fisicoquímicos en el interior y exterior del grano de cacao, dando origen a la formación de metabolitos secundarios que forman parte de los precursores de sabor y aroma, disminución de polifenoles y alcaloides (Machuca et al., 2019). Durante la fermentación predominan tres grupos de microorganismos: levaduras, bacterias ácido-lácticas y bacterias ácido-acéticas, cada una origina un metabolito secundario diferente y se refleja en la calidad sensorial del grano de cacao (Herrera-Rocha et al., 2021).
La presencia de esta microbiota en la masa fermentada de cacao se origina por inoculación natural proveniente del medioambiente, materiales utilizados en la labor, el fruto de cacao y la manipulación del agricultor (De Vuyst & Weckx, 2016). La función de estos microorganismos se divide en dos fases. A la primera fase se le denomina anaeróbica e intervienen las levaduras, cuya función es convertir el azúcar en etanol y ácidos orgánicos, mediante el cual se logra una hidrólisis de pectina y aumento de pH. Posteriormente, en condiciones anaeróbicas se inicia la función de bacterias que realizan el aumento de ácido láctico y ácido acético (Assi-Clair et al., 2019).
Para lograr una mejor comprensión de qué microorganismos están involucrados en los procesos de fermentación; se requiere una taxonomía de estos microorganismos relacionados con cada tipo de material genético de cacao y así mejorar de manera significativa los procesos de fermentación a nivel industrial (Chagas-Junior et al., 2021). La fermentación del cacao varía entre seis a ocho días, con esto ayudaría a la aceleración de procesos químicos mediante la adición de precursores como una opción para perfeccionar los procesos fermentativos. Debido a lo anterior, este estudio tuvo como objetivo la caracterización microbiológica, sensorial y bromatológica presente en el proceso fermentativo de los granos de cacao de los materiales genéticos ICS 95 e CCN 51, quienes tienen una amplia distribución y áreas establecidas en Colombia.
METODOLOGÍA
Materiales vegetales
Se utilizaron dos materiales genéticos de cacao: ICS 95 y CCN 51, el primer material fue cosechado en el municipio de San Vicente de Chucurí-Santander y el segundo genotipo en el municipio de Majagual-Sucre. Las colectas se realizaron con los lineamientos de la Resolución No. 1466 del 03 de diciembre de 2014 de la Autoridad Nacional de Licencias Ambientales (ANLA), que regula en Colombia la colecta de especímenes de la diversidad biológica con fines de investigación.
Fermentaciones y muestreos: los frutos del material genético ICS 95, fueron procesados en el área de postcosecha del Centro de Investigación la Suiza, ubicado en el municipio de Río negro, Santander, a 7° 22′ 12″ N, 73° 11′ 39″ W, Km 332 vía al mar, vereda Galápagos, donde se extrajo 243,15 kg de cacao húmedo, estos fueron ubicados en cajones fermentadores de madera con un diseño semi escalera con medidas: ancho 0,94 m, alto 0,70 m y de largo 2,6 m. Cada caja de madera tiene una capacidad de 243,15 g por tres repeticiones, lo que equivale a un total de 729,45 kg de grano húmedo. Esta herramienta permitió realizar la fermentación por espacios de siete días. A partir de las 48 h se realizó volteo cada 24 h y terminado el proceso de fermentación, el cacao fue llevado a proceso de secado, mediante secado solar.
Las mazorcas del material genético CCN 51 fueron procesadas en el Centro de Investigación Turipaná Ubicado en Km. 13, vía Montería - Cereté, Córdoba; utilizando un fermentador en escalera elaborado en madera que constaba de tres (3) cajones dispuestos en forma de escalones con medidas ancho 0,4 m, alto 0,6 m y largo 1,0 m, con capacidad de fruto por caja de madera de 378 kg, para un total 1.134 kg de grano húmedo y se procedió con fermentación por espacio de siete días a partir de las 48 h, realizando volteo cada 24 h.
Para el procesamiento del análisis microbiológico, se tomaron cuatro a seis granos de la masa de fermentación para cada genotipo cada 24 h en frascos estériles. Una vez terminado el proceso de secado y verificado el porcentaje de humedad en un 7% (ICONTEC NTC 1252, 2021), se tomaron granos secos para el análisis sensorial, bromatológico y funcional.
Aislamiento y purificación de microorganismos
En el Laboratorio de Microbiología del Centro Investigación Turipaná-Agrosavia, se procedió a hacer el aislamiento y purificación de los microorganismos, aplicado técnicas microbiológicas convencionales, tomando 10 g de los granos húmedos y agregándolos en 90 mL de solución salina 0,85%. La dilución madre se mezcló con vortex durante 5 min, para realizar las diluciones seriadas hasta 10-5. Para el aislamiento se realizó placa por esparcimiento y para la purificación siembra por estriado en superficie en medio de cultivo Agar extracto de levadura-glucosa-cloranfenicol (GYC, siglas en inglés) descrito por Swings (1992) (g L-1: carbonato cálcico 5 g, glucosa 50 g, extracto de levadura 10 g, agar 10 g y pH: 6.8±0.2), Agar MRS (MAN, ROGOSA y SHARPE), sembrándose en cada medio 100 µL de las diluciones 10-3, 10-4 y 10-5 por triplicado e incubando a una temperatura de 30 ± 2°C durante 48°C.
Caracterización morfológica
Se realizó una descripción de los aislamientos mediante observaciones macro y microscópicas de los cultivos puros, usando para las observaciones microscópicas tinción de Gram (Gram, 1884) en microscopio binocular (Leica®, DM500, USA). Para la caracterización macroscópica, los cultivos puros se monitorearon a las 48 h después de siembra, se describieron características como forma, margen, elevación, superficie, aspecto, color y forma de la célula (Bergey, 1994). La caracterización morfológica permitió la agrupación de levaduras y bacterias en morfotipos, acorde a la semejanza en las características macro y microscópicas.
Caracterización molecular, fúngica y bacteriana
La extracción del ADN de las levaduras se realizó utilizando un kit comercial de la marca Mo Bio (AllPrep® Fungal DNA/RNA/Protein Kit) siguiendo el protocolo establecido por el fabricante. Se identificaron las cepas fúngicas mediante el uso de las secuencias del gen ITS ARN ribosomal. La amplificación por PCR del ADN se realizó usando el kit Tucán Taq (CorpoGen®). La amplificación se efectuó utilizando los primeros ITS5 (GGAAGTAAAAGTCGTAACAAGG) e ITS4 (5'GGAAGTAAAAGTCGTAACAAGG-'3) (White, 1990). Cada reacción de PCR se calculó para un volumen final de 25µL, utilizando Tucan Taq polymerase (CorpoGen®), 8 µM de cada primer (F y R) y 3µL de ADN (20 ng.µL-1). Cada amplificación se ejecutó en un termociclador BioRad C1000 Thermal Cycler, Hercules, CA, USA), utilizando las siguientes condiciones: un paso de desnaturalización a 95°C durante 3 minutos, seguido por 34 ciclos de desnaturalización 95°C por 1 minutos, hibridación 52°C por 30 segundos, elongación 72°C por 1 minutos, y un ciclo final de extensión 72°C por 10 minutos.
La caracterización molecular de las cepas bacterianas se realizó mediante la amplificación y secuenciación del gen 16S ARN ribosomal. La amplificación por PCR del ADN se realizó usando el kit Tucán Taq (CorpoGen®) a partir de cada colonia individual de los morfotipos seleccionados; mediante el empleo de los siguientes primers universales: 337F(GACTCCTACGGGAGGCWGCAG), 518F(CCAGCAGCCGCGGTAATACG), 800R (TACCAGGGTATCTAATCC) y 1100R (GGGTTGCGCTCGTTG) (Muyzer et al., 1993; Techo et al., 202). Se empleó el termociclador (BioRad C1000 Thermal Cycler, Hercules, CA, USA) y las condiciones fueron: desnaturalización inicial 94°C por 9 minutos, seguido por un ciclo desnaturalización a 94°C por 45 segundos, alineación a 55°C por 45 segundos, extensión a 72°C por 30 ciclos y una extensión final a 72°C por un minuto.
Los productos de PCR amplificados se separaron mediante electroforesis en gel de agarosa al 1%. El buffer usado para la preparación del gel y la corrida fue buffer TAE1X. Se utilizó EZ-vision® (Amresco Inc., USA) como revelador y como marcador molecular el Gene ruler de 1kb de (Thermo Fisher Scientific Inc., USA). El gel fue examinado en un equipo para el análisis y la documentación de geles (Biorad Gel, Doc XR System, USA).
Identificación molecular: los productos PCR fueron secuenciados por CorpoGen® utilizando el secuenciador ABI PRISM® 3730XL Analyzer (96 capillary type, USA), siguiendo los protocolos de los fabricantes. Para las levaduras se ejecutó la limpieza y ensamblaje de las secuencias Forward y Reverse para obtener la secuencia problema, empleando el software Bioedit (Versión 7.0.5.3, Carlsbad, USA). Posteriormente, se realizó el análisis taxonómico de la secuencia mediante la herramienta BLAST (Basic Local Alignment Search Tool), del NCBI (National Center for Biotechnology Information), comparando contra la colección de nucleótidos (nr/nt), del mismo NCBI, que comprende las bases de datos: GenBank, EMBL (European Molecular Biology Laboratory), DDBJ (DNA Data Bank of Japan), PDB (Protein Data Bank) y RefSeq. Luego, se realizó un análisis taxonómico de la secuencia mediante la herramienta “Classifier”, alojada en el sitio Web de RDP (Ribosomal Data Project), comparando contra la base de datos “Warcup Fungal ITS trainset 2”. Por último, se estableció la clasificación taxonómica de la secuencia consenso.
Las secuencias obtenidas de las bacterias fueron limpiadas y ensambladas en una secuencia consenso Forward y Reverse, usando el software Bioedit (Versión 7.0.5.3, Carlsbad, USA), para obtener la secuencia problema. Seguidamente, se realizó el análisis taxonómico de la secuencia problema mediante la herramienta BLAST (Basic Local Alignment Search Tool), del NCBI (National Center for Biotechnology Information), comparando contra la base de datos RNA de referencia refseq_rna. El análisis taxonómico de la secuencia problema mediante las herramientas Classifier y SeqMatch, alojadas en el sitio Web de RDP (Ribosomal Data Project). El primer recurso se utiliza para determinar la taxonomía de la secuencia problema; el segundo recurso se utiliza para identificar las secuencias más similares, en la base datos de RDP, con la secuencia problema. Ambas comparan mediante la base de datos "16S rRNA training set 16" de RDP. Luego, se efectuó el alineamiento utilizando el algoritmo MUSCLE (Multiple Sequence Comparision by Log-Expectation), de la secuencia problema con las secuencias de mayor similitud reportadas por BLAST.
La generación de los árboles filogenéticos para hongos y bacterias se realizó usando la distancia genética de Tamura-Nei (TN93) y el método de Neighbor-joining y el método de Bootstrap con mil réplicas. Posteriormente, la clasificación taxonómica de la secuencia consenso.
Análisis sensorial
El procesamiento de los granos ICS 95 y CCN 51, consistió en someter la muestra a torrefacción mediante el equipo Kaffe- Mat (Referencia:1220, Colombia), durante 10 minutos a 110°C, posteriormente, descascarillado mediante el equipo Cocoatown (Cracker Manual CocoaT, USA) y llevándose a cabo la molienda mediante el equipo Cocoatown (Melanger ECGC-12SLTA, USA), finalmente, refinado para obtener el licor de cacao. Las muestras obtenidas de licores de los dos materiales genéticos fueron codificadas y proporcionadas a cada evaluador de forma independiente. Por último, se hizo un consenso sobre los resultados, que consistieron en el perfil de sabor y aroma final.
Este análisis sensorial fue ejecutado bajo la normativa ICONTEC GTC 165, 2014 (Metodología de Análisis sensorial) y la ICONTEC NTC 3929, 2009 (metodología del perfil de sabor), y se empleó un panel sensorial en entrenado conformado por 11 panelistas y un evaluador experto, cuyos jueces fueron formados bajo la normativa vigente (ICONTEC NTC 5278, 2004; ICONTEC GTC 280, 2017; ICONTEC GTC 232, 2020 y ICONTEC NTC 3501, 2012). Se valoraron los descriptores de sabores básicos (amargo, astringente y ácido), los atributos positivos (cacao, frutal, floral, dulce, frutos secos y especiado) y los descriptores negativos (humedad, verde y sobre fermentado), en una escala de 0 a 10, en donde cero es ausente, 1 a 2 es bajo, 3 a 6 es medio, 7 a 9 es alto y 10 muy alto, para ello se utilizó un análisis descriptivo y cualitativo por consenso.
Análisis bromatológico y funcional: se realizó un estudio cuantitativo de análisis bromatológico en el Laboratorio de Alimentos CICTA de la Universidad Industrial de Santander. Se analizaron los granos ICS 95 y CCN 51, se determinaron los parámetros de proteínas por el método de Kjeldahl, de acuerdo con el procedimiento interno de laboratorio (Análisis de proteína en alimentos código GOMEPL.01 V.08 2019-04-01). Los carbohidratos se cuantificaron matemáticamente de acuerdo con la resolución 333 del 2011 Numeral 9.3, la acidez titulable se determinó con el procedimiento descrito en la AOAC 942.15 (2005) y la cuantificación de la teobromina, cafeína, catequina y epicatequina teobromina, catequina y epicatequina se realizó por HPLC Dionex Ultimate 3000, controlado por el Software Chromeleon 7.2, equipado con una columna (Agilent Eclipse XDB-C18 150 mm x 2.1 mm x 5 µm). La teobromina y cafeína fueron cuantificadas empleando un detector UV a 273 nm. Las procianidinas fueron cuantificadas usando un detector UV a 204 nm. El resultado se expresó en mg EP (equivalentes de procianidina B1) por gramo de muestra.
RESULTADOS Y DISCUSIÓN
Morfotipos fúngicos y bacterianos
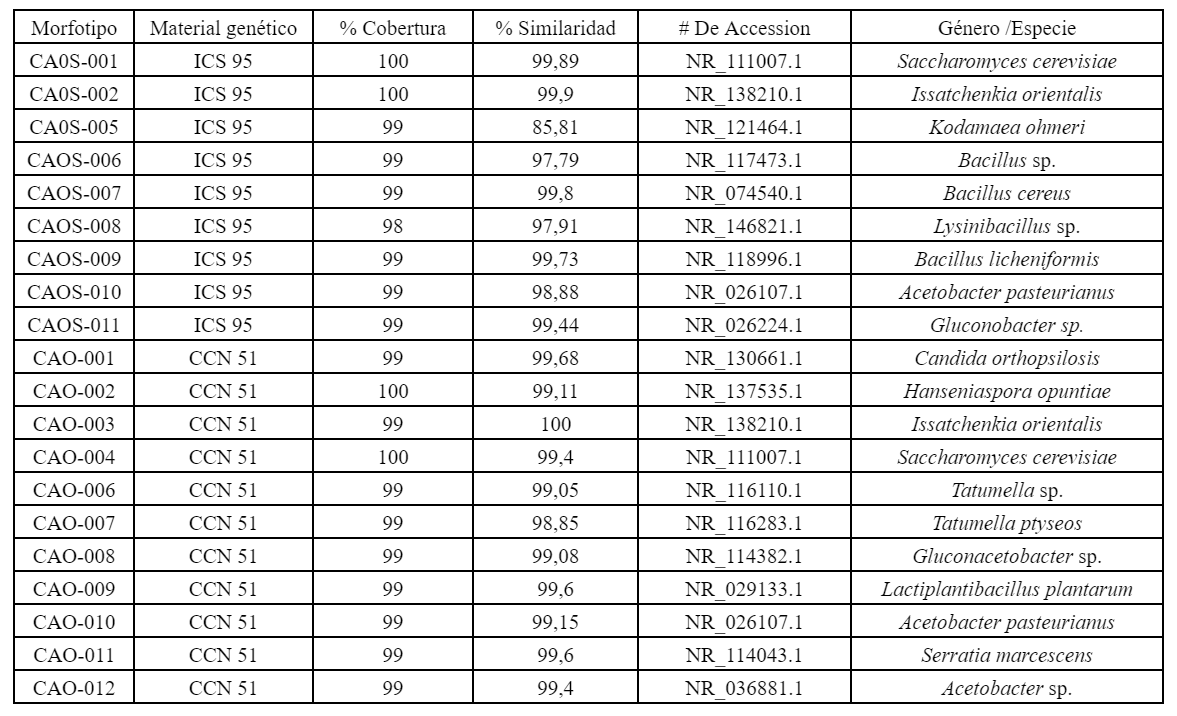
A partir de la fermentación de los granos de cacao para el material genético ICS 95 se extrajeron 210 microorganismos, que equivalen a 36 levaduras y 72 bacterias. Se hallaron 40 levaduras y 62 bacterias en el material genético CCN 51, lo que suma un total de 102 microorganismos.
La semejanza en las características macro y microscópicas de los aislamientos y de las levaduras permitió la formación de siete morfotipos de levaduras para los materiales genéticos ICS 95, conformada por tres morfotipos, y el material genético CCN 51, conformada por cuatro morfotipos.
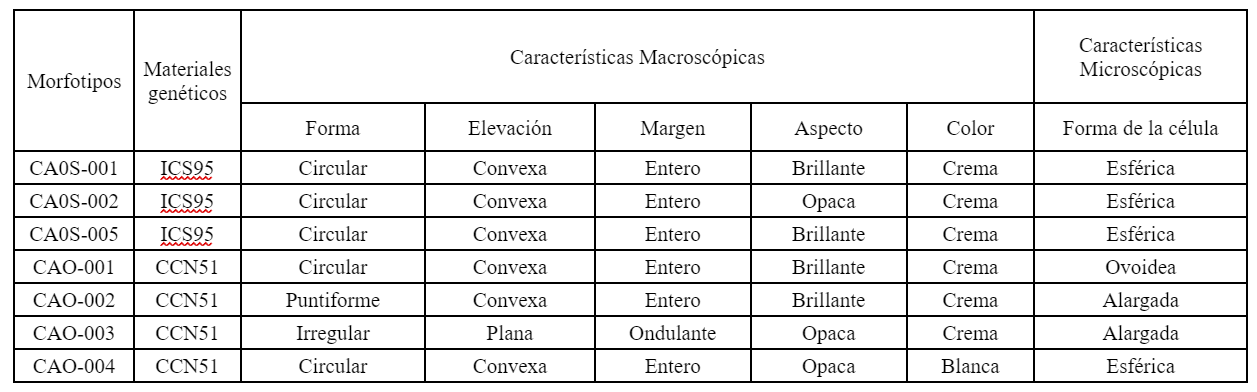
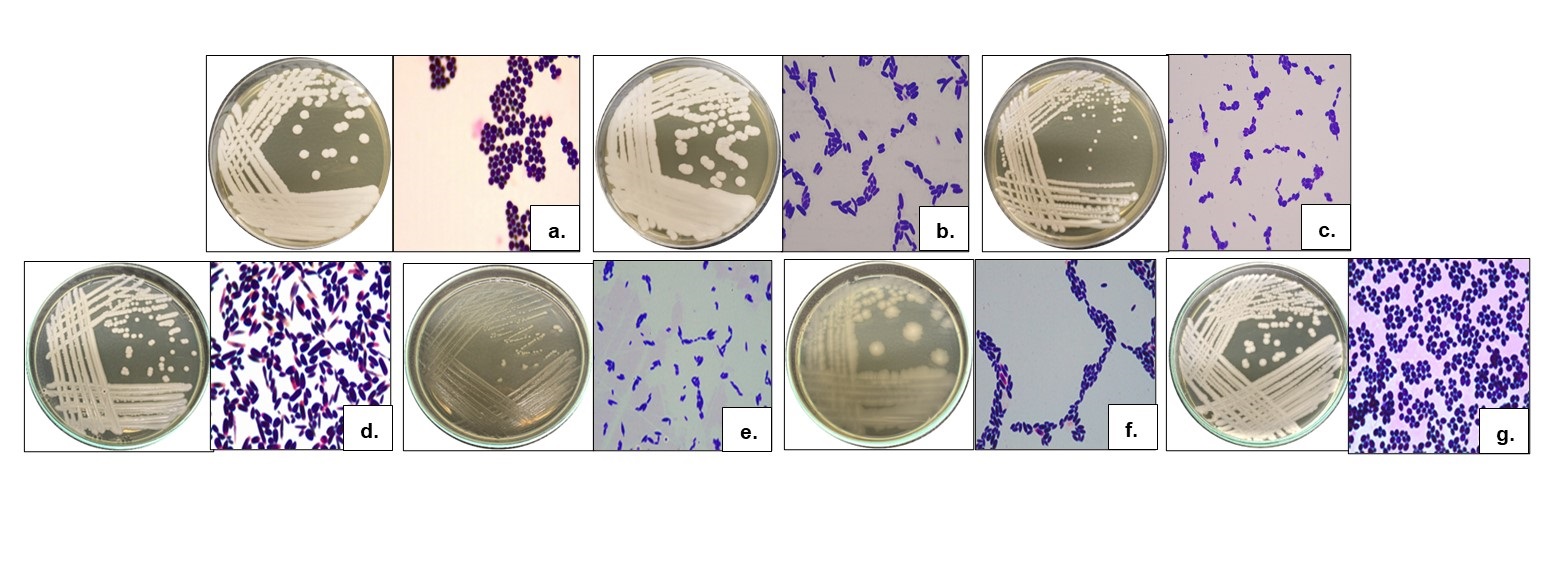
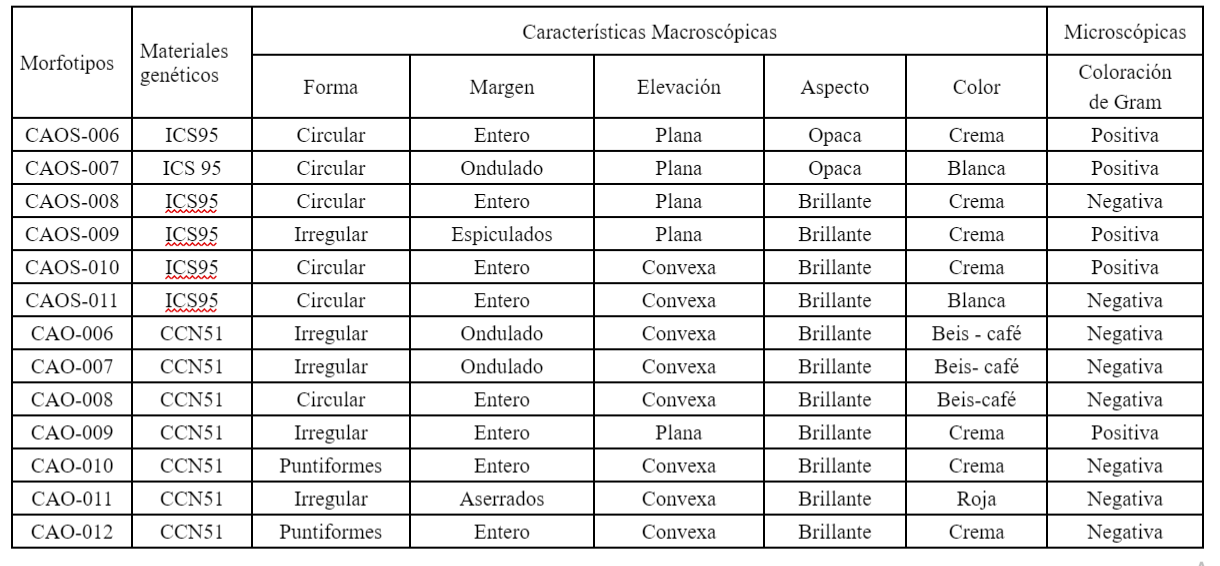
En cuanto a la caracterización de las bacterias, la similitud en las características macro y microscópicas permitió la conformación de 13 morfotipos para los materiales genéticos ICS 95 y CCN 51. El material genético ICS 95 se integra por seis morfotipos, mientras que el CCN 51 por siete morfotipos (Tabla 2) (Figura 2).
Identificación molecular de levadura y bacterias
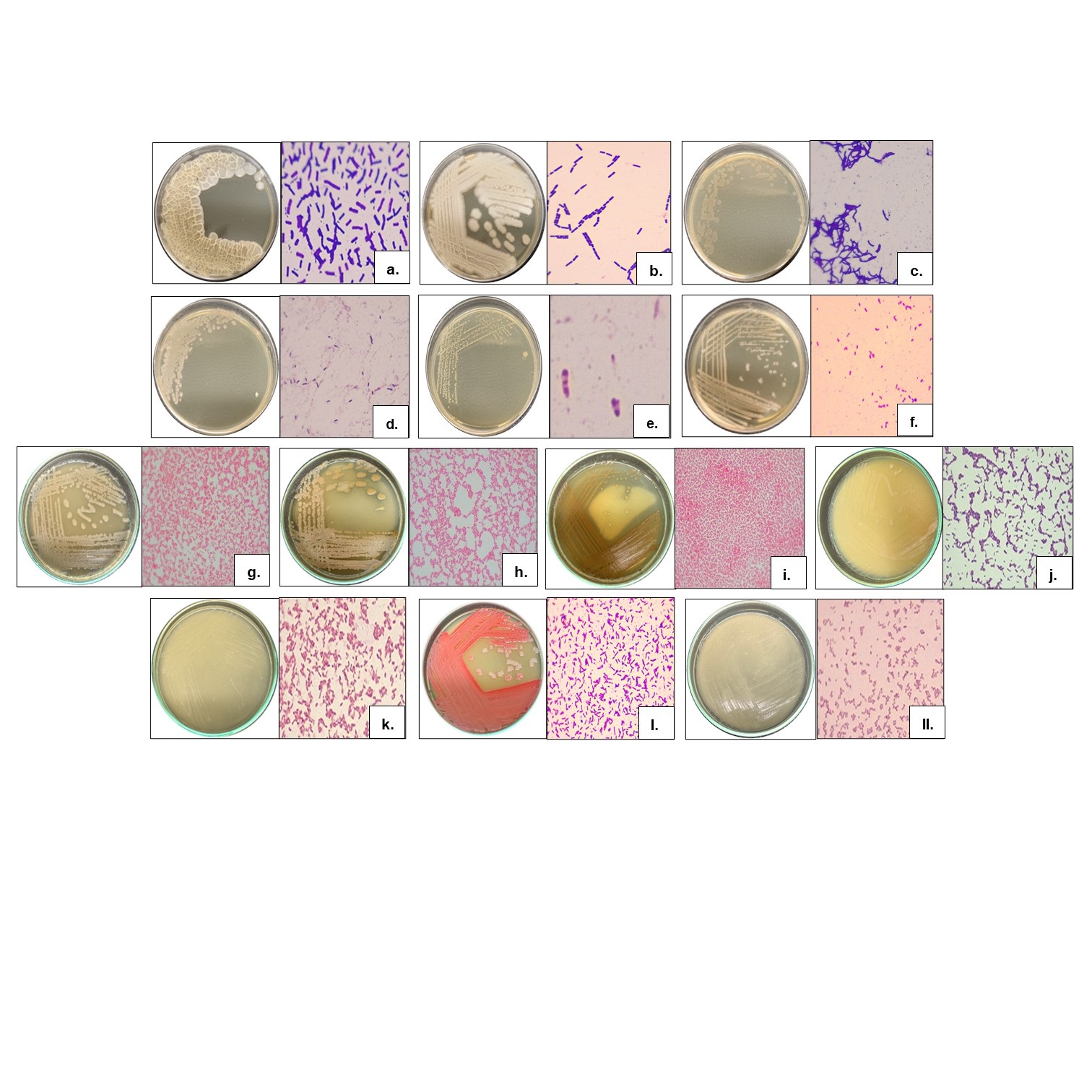
Se realizó la amplificación del ADN de los siete (7) morfotipos de levaduras para la región ITS y, como resultado de la secuenciación de Sanger, se obtuvo secuencias en sentido Forward y Reverse de los productos PCR de la región ITS. Las secuencias fueron editadas y se adquirió la secuencia consenso, la cual fue alineada con secuencias del Genbank®, para determinar su identidad. Se identificaron un total de tres (3) especies de levaduras que presentaron la mayor similaridad y cobertura con las secuencias de la región ITS, correspondientes al material genético ICS 95 y cuatro (4) especies correspondientes, para el material genético CCN 51 (Tabla 3) (Figura 3). El análisis de las secuencias del gen 16S ARN ribosomal permitió identificar 13 morfotipos correspondientes a tres (3) géneros y tres (3) especies para el material genético ICS 95, así como tres (3) géneros y cuatro (4) especies para el material genético CCN 51 asociados a las fermentaciones (Tabla 3) (Figura 4).
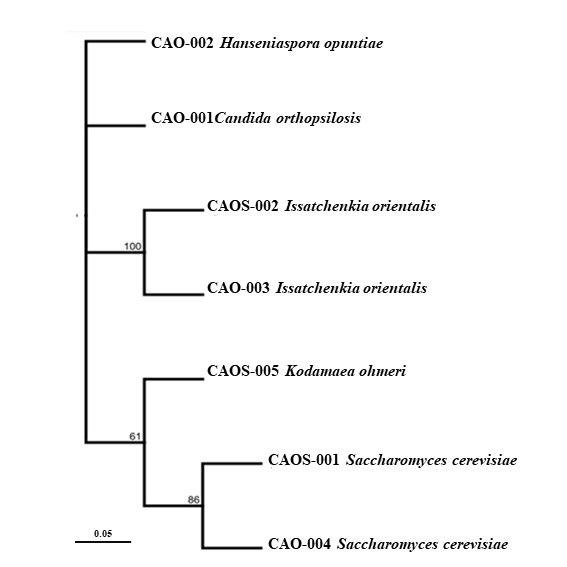
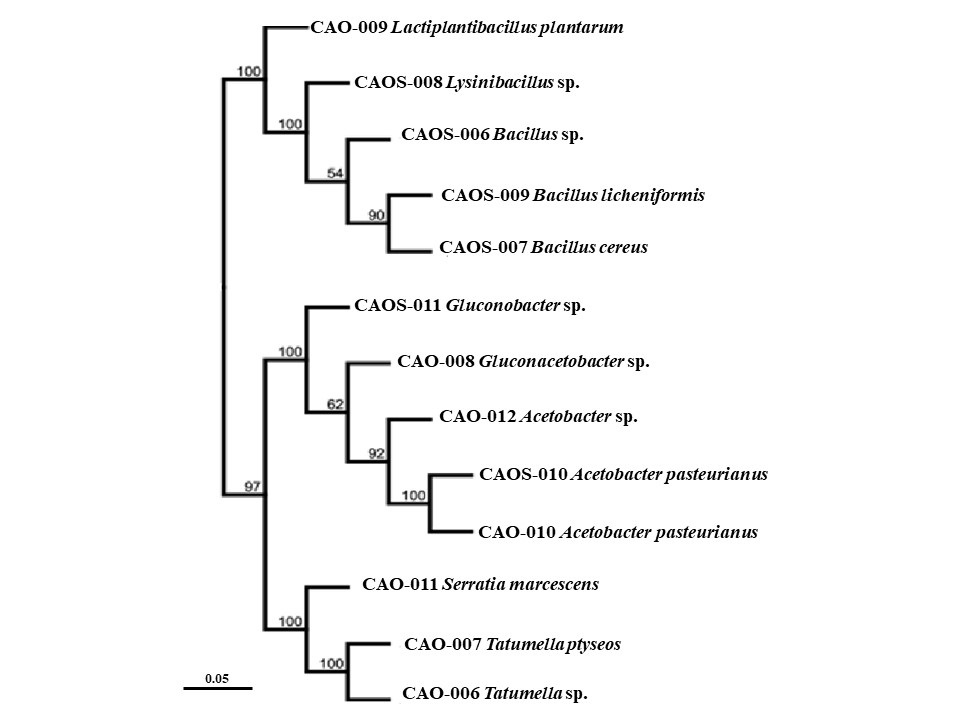
En el presente estudio se han encontrado cuatro grupos importantes de microorganismos que participan en la fermentación del cacao, como las levaduras, las bacterias ácido lácticas, bacterias del ácido acético y varias especies de bacilos. En el proceso de fermentación de las semillas de cacao, los microorganismos desempeñan un papel importante; se puede subdividir esta fermentación en tres fases: durante la primera fase actúan las levaduras, en la segunda se desarrollan las bacterias lácticas y en la tercera las bacterias acéticas (Sinche-Bósquez, 2013).
Las levaduras presentes en el estudio se identificaron como: Saccharomyces cerevisiae, Issatchenkia orientalis, Kodamaea ohmeri, Candida orthopsilosis y Hanseniaspora opuntiae, son microorganismos que se han estudiado con un alto potencial biotecnológico para la industria alimentaria (Rai et al., 2019). En diversos estudios se han identificado como los principales colonizadores durante las primeras etapas de fermentación del cacao, el licuado de la pulpa mediante la despectinización, así como la reducción de la viscosidad de la pulpa y el etanol a partir de azúcares y ácido cítrico en condiciones anaeróbicas en un entorno rico en carbohidratos (Camu et al., 2008; Ordoñez-Araque et al., 2020). De acuerdo con los informes elaborados por Llerena & Uriña (2017), la levadura S. cerevisiae es la primera en actuar dentro del proceso de fermentación del cacao. Asimismo, Schwan & Wheals (2004) revela que la levadura S. cerevisiae no solo es capaz de descomponer el azúcar y convertirlo en alcoholes, sino que también presenta la actividad pectinolítica que ayuda a mejorar las propiedades organolépticas de la almendra de cacao durante la fermentación. De igual modo, se ha señalado la capacidad de S. cerevisiae para descarboxilar los aminoácidos y presenta la capacidad de producir tiramina e histamina durante la fermentación alcohólica (Costantini et al., 2009).
Los resultados de este estudio muestran la presencia del género Candidarepresentado por la especie Candida orthopsilosis, lo cual es relevante al comparar con estudios anteriores, realizados por Rivera (2017), el cual establece una relación entre la presencia de Candida halmiae y Candida awuaii en el proceso de fermentación del cacao, lo que contribuye al consumo de azúcares y la producción de etanol.
En la segunda fase de la fermentación se pudo identificar una especie y un género de bacterias ácido lácticas Lactiplantibacillus plantarum . Lysinibacillus sp. Estas bacterias están directamente distribuidas ubicuamente en la naturaleza (Rodrigo-Torres et al., 2019; Brandt et al., 2020), debido a sus características probióticas y antimicrobianas; varias de estas bacterias se incorporan en diferentes alimentos que confieren beneficios para la salud de los consumidores, así como en la seguridad alimentaria al inhibir la proliferación de deterioro indeseables de microorganismos patógenos (Fernández et al., 2013). Los informes presentados por López-Súarez et al. (2021) indican que la presencia de Lactobacillus sp. en los procesos de fermentación es relevante debido a su contribución a la calidad de grano. Sin embargo, estudios realizados por Lima et al. (2021) según señalan, a pesar de su baja prevalencia y de que su aporte al resultado final del chocolate es mínimo, sigue presencia de ácido láctico al finalizar la fermentación.
Varios estudios han revelado que la buena interacción con las levaduras durante las primeras horas de fermentación degrada los azúcares fermentables de la pulpa, como es el caso de la glucosa, sacarosa y fructosa. Presentándose distinción por la fructosa y convirtiéndolas en ácido láctico, ácido acético, etanol, dióxido de carbono y manitol (Delgado-Ospina et al., 2021; Mendoza-Salazar et al., 2022). En tanto que se drena la pulpa, se produce la formación de etanol y se aumentan tanto la temperatura como el pH, lo que crea las condiciones ideales para el crecimiento de las bacterias ácido acéticas que utilizan este alcohol para hacer una fermentación en condiciones aeróbicas (Camu et al., 2008). Durante el estudio se pudo identificar tres (3) géneros de bacterias ácido acéticas como el A. pasteurianus, Gluconobacter sp. y Gluconoacetobacter sp. En varios estudios se han señalado que estas bacterias son capaces de utilizar el alcohol para hacer fermentación en condiciones aeróbicas, lo que a su vez aumenta la concentración de ácidos acéticos en la semilla de cacao y disminuye el pH interno de la fermentación. Dado que consumen el oxígeno, es inevitable realizar remociones para que entre aire fresco y se libere el CO2 acumulado. Al realizar las remociones, se volatiliza una parte del ácido acético, lo que mejora el sabor del cacao (Farrera et al., 2021; Yang et al., 2022). Según las investigaciones reportadas por Adler et al. (2014) y Lefeber et al. (2010), el A. pasteurianus es una especie dominante en la fermentación del cacao debido a que oxida el etanol y es resistente a las condiciones de estrés en la fermentación.
Finalmente, durante el proceso de la fermentación en este estudio se han aislado una serie de bacterias como: Tatumella sp., Tatunella ptyseos, Bacillus sp. Bacillus cereus y Bacillus licheniformis que pueden hacer parte de consorcios con las levaduras presentes en el estudio y estar ligadas a la producción de enzimas pectinolíticas como la poligalacturonasa durante la fermentación. Se promueve la degradación de la cadena de pectina que recubre la pulpa de la semilla y, asimismo, se facilita la formación de pirazina en la etapa de secado y en la terminación del tostado de los granos de cacao (Figueroa-Hernández et al., 2019; Assi-Clair et al., 2019). En cuanto a la bacteria Serratia marcescens presente en la fermentación de genotipo CC N51, no hay evidencia bibliográfica para validar las funciones, pero ha sido reportada por varios estudios de fermentaciones de cacao de donde se ha aislado y caracterizado molecularmente (Ostovar & Keeney, 1973; Binh et al., 2017; Adeniran et al., 2020).
Análisis sensorial de los granos
Como resultado del análisis sensorial se obtiene el perfil de sabor de los dos materiales genéticos de cacao. Se observa que el material genético ICS 95 presenta una mayor intensidad de sabor a cacao. Con un sabor de nuez y una puntuación en la escala de 4, sus sabores básicos son amargo y astringente. Al percibirlo, se encuentra en una escala mediana, acompañado de una acidez cítrica, notas frutales, dulce y notas bajas de floral y herbal. Como punto negativo se encuentra la cuantificación de notas verdes, pero estas se presentan en intensidad baja, por lo que no tiene influencia negativa sobre el perfil final del material. El perfil sensorial del material genético CCN 51 revela los sabores básicos más intensos, con una calificación de 6, acompañado de notas ácidas, cítricas y notas medias de cacao, nuez y herbal; la puntuación negativa se refleja hacia los descriptores de humedad y verde (Figura 5).
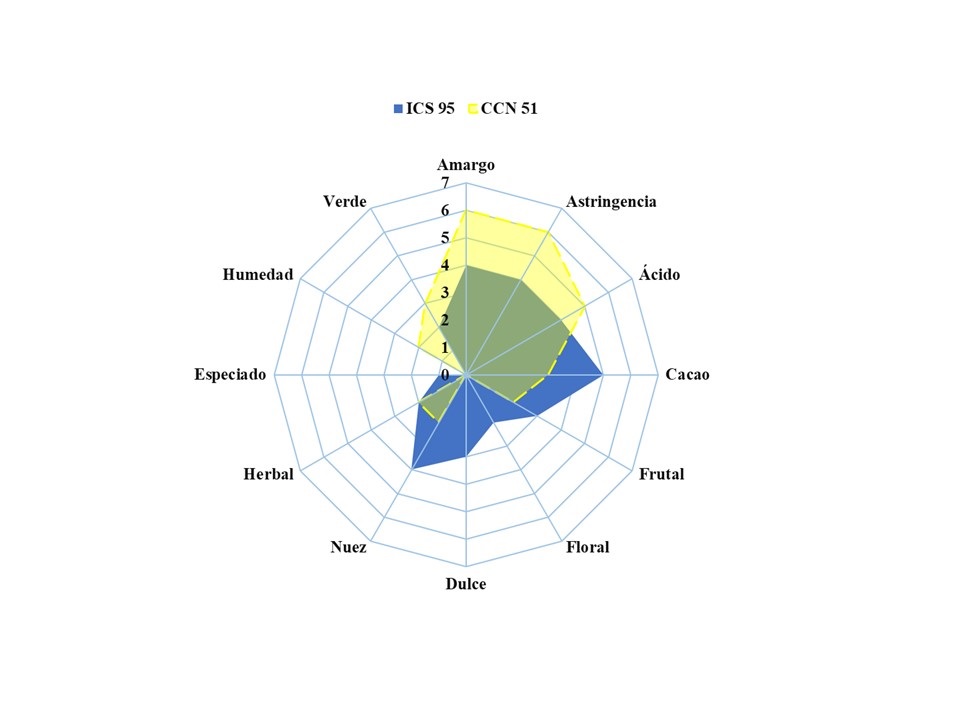
El perfil sensorial puede verse influenciado por la genética de la variedad de cacao; en el caso del ICS 95 considerado un material trinitario, se reporta con sabores de nuez y afrutados. Por el contrario, el CCN 51 está compuesto principalmente por material genético de triple cruzamiento, con una predominancia de genética forastera. Se caracteriza por ser cacao de granel, con un predominio de sabores básicos (amargo, astringente, ácido) y una carencia de descriptores floral y frutos secos) (Jaimez et al., 2022; Quintana-Fuentes et al., 2018).
El sabor y aroma del cacao es dado por diversos factores como la genética, condiciones agroclimáticas, manejo agronómico, procesos de postcosecha y procesos de transformación; en los procesos de postcosecha la fermentación es un proceso vital dado que en esta actividad es donde origina los precursores de sabor y aroma mediante la proteólisis que inicia el ácido de las proteínas que tienen los cotiledones (Scalone et al., 2019).
Análisis bromatológico y funcional
Otros factores que pueden influenciar en el perfil sensorial son su composición bromatológica y funcional (Tabla 4).
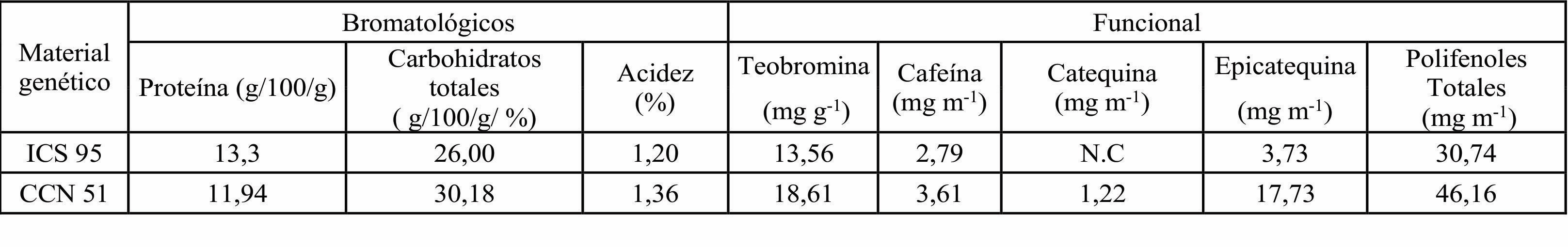
En cada material genético de cacao, el contenido de proteínas presenta una variación. El material ICS 95 presenta una mayor concentración de proteínas en comparación con el CCN 51, como se mencionó anteriormente, la relación entre las proteínas en la formación de precursores de sabor y aroma se podría correlacionar con el perfil de sabor encontrado en las muestras, donde el ICS 95 presenta una mayor presencia de sabores específicos como: afrutado, dulces y nuez. No obstante, para este estudio se finalizó el proceso de fermentación y secado, lo que implica plantear la medición de esta variable al comienzo del proceso y al final, es decir, en granos frescos y fermentados. En investigaciones realizadas por Warren et al. (2016) se han encontrado proteínas de almacenamiento y oligopéptidos como la vicilina, los cuales se consideran precursores de sabores en el cacao. Así como también se ha reportado que por efecto de la fermentación en los granos de cacao hay aumento de péptidos, aminoácidos libres y azúcares reductores, componentes que se relacionan como precursores de sabor y aroma de los granos de cacao (Rojas-Molina et al., 2021).
Otras variables que afectan el perfil sensorial en la intensidad del ácido, en los resultados obtenidos se observa que la presencia de ácido acético presenta una variación mínima de acuerdo con genotipo evaluado, en donde el ICS 95 presenta menor acidez acética (1,20%) en comparación al CCN 51 (1,36%), esta diferencia mínima pudiera verse relacionada por la actividad microbiana que se presenta en la localidad donde se fermentó. De acuerdo a reportes efectuados por Camu et al. (2008) el ácido acético en masa fermentada puede llegar a concentraciones de 2,0% m/m; esta concentración es efecto de la influencia de las bacterias ácido acéticas, ya que estas oxidan el etanol y se produce el ácido acético (Figueroa-Hernández et al., 2019). En estudios realizados, Ouattara-Niamké (2021) menciona que la cepa bacteriana ácido acética predominante en la fermentación fue L. plantarum, la cual se acompaña de otras especies que se asocian a la zona de donde se realizó la fermentación, sin embargo, esta diversidad microbiana presenta variables mínimas en la concentración de ácido acético.
De igual forma, en el grano seco Castañeda-Sedano et al. (2016) reportan que la presencia de ácidos es mayor en materiales genéticos con genética forastera en comparación a los criollos, lo que conlleva a relacionar que las diferencias mínimas encontradas en los materiales evaluados están relacionadas con la genética de los materiales, dado que el CCN 51 es considerado un material forastero y el ICS 95 un material trinitario (F&M Consulting, 2008).
Los granos de cacao contienen componentes funcionales como los polifenoles (15% de peso seco) y alcaloides (4%), que influyen en el sabor y aroma (Vázquez-Ovando et al., 2016). Por la acción de los microorganismos en el proceso de fermentación se generan cambios bioquímicos de estos componentes, dándose la disminución de los principales polifenoles (catequina y epicatequina), estudios demuestran la relación de los polifenoles, la teobromina y cafeína con la intensidad de sabores amargos astringente, evidenciándose que hay un efecto favorable de la fermentación en la disminución de la intensidad de estos sabores y la calidad sensorial de los granos de cacao (Rojas-Molina et al., 2021). De acuerdo con lo anterior y los reportes obtenidos se puede evidenciar que el material ICS 95 no reporta presencia de algunos polifenoles principales como lo es la catequina, relacionando estos valores con los resultados de análisis sensorial se puede evidenciar que el ICS 95 presenta menor intensidad (valoración de 4) del sabor amargo y astringente en comparación al CCN 51(valoración de 6).
Acorde a los estudios Lima et al. (2021) sugieren que al probar un inóculo iniciador compuesto por cepas de H. opuntiae y A. pasteurianus; se pueden lograr mejoras significativas en los atributos del grano de cacao. Se consideran relevantes para este estudio, puesto que han sido especies reportadas a partir de las pruebas de laboratorio, convirtiéndose en especies promisorias para la estandarización de los procesos fermentativos del cacao.
De acuerdo con lo anterior, otras investigaciones han demostrado que el uso de microorganismos como cultivos indicadores pueden mejorar la calidad sensorial de los granos de cacao, lo que conlleva a este estudio a enfocarse en siguientes etapas de selección y aplicación de microorganismos con direccionamiento de sabores específicos que puedan garantizar su efecto en la calidad final del producto.
CONCLUSIONES
Se identificaron varias especies que fueron consistentes y dominantes a lo largo de las fermentaciones para los genotipos CCN 51 e ICS 95. Destacándose para genotipo CCN 51 los microrganismos: C. orthopsilosis, H. opuntiae, I. orientalis, S. cerevisiae, Tatumella sp. T. ptyseos, Gluconacetobacter sp. L. plantarum, A. pasteurianus, S. marcescens y Acetobacter sp. Por el contrario, para la fermentación del genotipo ICS 95 se identificaron los microorganismos: S. cerevisiae, I. orientalis, K. ohmeri, Bacillus sp., B. cereus, Lysinibacillus sp., B. licheniformis, A. pasteurianus . Gluconobacter sp.
El uso de microorganismos como cultivos indicadores pueden mejorar la calidad sensorial de los granos de cacao, lo que conlleva a este estudio a enfocarse en siguientes etapas de selección y aplicación de microorganismos con direccionamiento de sabores específicos que puedan garantizar su efecto en la calidad final del producto.
AGRADECIMIENTOS
A los Laboratorios de los Centros de Investigación, Turipaná y La Suiza-Agrosavia y al Laboratorio de alimentos CICTA de la Universidad Industrial de Santander. Conflicto de intereses. Este estudio fue financiado proyecto con recursos del Sistema General de Regalías, identificado con el código BPIN Nro. 2013000100255.
BIBLIOGRAFÍA
Adeniran, H.A., Adeniyi, D.M., & Taiwo, K.A. 2020. Microbiological Properties of Probioticated Kununzaki Drink Enriched with Cocoa Powder. European j. agric. food sci. 2(6),1-9. http://dx.doi.org/10.24018/ejfood.2020.2.6.139
Adler, P., Frey, L.J., Berger, A., Bolten. C.J., Hansen, C.E., & Wittmann C. 2014. The key to acetate: metabolic fluxes of acetic acid bacteria under cocoa pulp fermentation-simulating conditions. Appl. Environ. Microbiol. 80(15),4702-4716. https://doi.org/10.1128/AEM.01048-14
AOAC. Official methods of Analysis of the Association of Official Analytical Chemists. AOAC Official Method 942.15 Acidity (Titratable) of Fruit Products 18th edn. (AOAC INTERNACIONAL, 2005).
Assi-Clair, B.J, Koné, M.K., Kouamé, K., Lahon, M.C., Berthiot, L., Durand, N., ... & Guéhi TS. 2019. Effect of aroma potential of Saccharomyces cerevisiae fermentation on the volatile profile of raw cocoa and sensory attributes of chocolate produced thereof. Eur. Food Res. Technol. 245(7),1459-1471. https://doi.org/10.1007/s00217-018-3181-6
Bergey, D.H. 1994. Bergey's manual of determinative bacteriology. Ed. Lippincott Williams. USA.763p.
Binh, P.T., Tru, N.V., Dung, V.T., Thoa, N.T., & Thao, P.V. 2017. Bacteria in Wooden Box Fermentation of Cocoa in Daklak, Vietnam. J. Microbiol. Exp. 5(7),00176. https://doi.org/10.15406/jmen.2017.05.00176
Brandt, K., Nethery, M.A., O’flaherty, S., & Barrangou, R. 2020. Genomic characterization of Lactobacillus fermentum DSM 20052. BMC Genom.21(1),1-13. https://doi.org/10.1186/s12864-020-6740-8
Camu, N., De Winter, T., Addo, S.K., Takrama, J.S., Bernaert, H., & De Vuyst, L. 2008. Fermentation of cocoa beans: influence of microbial activities and polyphenol concentrations on the flavour of chocolate. J. Sci. Food Agric. 88(13), 288-2297. https://doi.org/10.1002/jsfa.3349
Castañeda-Secano, J., Rodriguez-Campos, J., & Lugo-Cervantes, E. 2016. Análisis del perfil de compuestos Volátiles de cacao criollo, durante el proceso de fermentación y secado por componentes. Disponible desde Internet en: https://ciatej.repositorioinstitucional.mx/jspui/bitstream/1023/414/1/An%C3%A1lisis%20del%20perfil%20de%20compuestos%20vol%C3%A1tiles.pdf (con acceso el 28/02/2023).
Cevallos-Cevallos, J.M., Gysel, L., Maridueña-Zavala, M.G., & Molina-Miranda, M.J. 2018. Time-related changes in volatile compounds during fermentation of bulk and fine-flavor cocoa (Theobroma cacao) beans. J. Food Qual. 1-14. https://doi.org/10.1155/2018/1758381
Costantini, A., Vaudano, E., Del Prete, V., Danei, M., & Garcia-Moruno, E. 2009. Biogenic amine production by contaminating bacteria found in starter preparations used in winemaking. J. Agric. Food Chem.57(22),10664-10669. https://pubs.acs.org/doi/abs/10.1021/jf9025426
Chagas-Junior, G.C.A., Ferreira, N.R., & Lopes, A.S. 2021. The microbiota diversity identified during the cocoa fermentation and the benefits of the starter cultures use: An overview. Int. J. Food Sci. Technol. 56(2),544-552. https://doi.org/10.1111/ijfs.14740
De Vuyst, L., & Weckx, S. (2016). The functional role of lactic acid bacteria in cocoa bean fermentation. In: F. Mozzi, R.R. Raya & G.M. Vignolo (Eds.), Biotechnology of lactic acid bacteria: Novel applications. (pp301-326). Editions Blackwell-Wiley.
Delgado-Ospina, J., Acquaticci, L., Molina-Hernandez, J.B., Rantsiou, K., Martuscelli, M., Kamgang-Nzekoue, A.F., & Chaves-López, C. 2021. Exploring the Capability of Yeasts Isolated from Colombian Fermented Cocoa Beans to Form and Degrade Biogenic Amines in a Lab-Scale Model System for Cocoa Fermentation. Microorganisms. 9(1),28. https://www.mdpi.com/2076-2607/9/1/28
F&M Consulting. 2008. Estudio de caracterización del potencial genético de cacao en el Perú. Disponible desde Internet en: http://infocafes.com/portal/wp-content/uploads/2016/07/estudio_potencial_genetico.pdf (con acceso el 28/02/2023).
Fang, Y., Li, R., Chu, Z., Zhu, K., Gu, F., & Zhang, Y. 2020. Chemical and flavor profile changes of cocoa beans (Theobroma cacao L.) during primary fermentation. Food Sci. Nutr. 8(8),4121-4133. https://doi.org/10.1002/fsn3.1701
Farrera, L., Colas De La Noue, A., Strub, C., Guibert, B., Kouame, C., Grabulos, J., ... & Teyssier, C. 2021. Towards a Starter Culture for Cocoa Fermentation by the Selection of Acetic Acid Bacteria. Fermentation. 7(1),42. https://doi.org/10.3390/fermentation7010042
Fernández, L., Langa, S., Martín, V., Maldonado, A., Jiménez, E., Martín, R., & Rodríguez, J.M. 2013. The human milk microbiota: origin and potential roles in health and disease. Pharmacol. Res. 69(1),1-10. http://dx.doi.org/10.1016/j.phrs.2012.09.001
Figueroa-Hernández, C., Mota-Gutierrez, J., Ferrocino, I., Hernández-Estrada, Z.J., González-Ríos, O., Cocolin, L., & Suárez-Quiroz, M.L. 2019. The challenges and perspectives of the selection of starter cultures for fermented cocoa beans. Int. J. Food Microbiol. 301,41-50. https://doi.org/10.1016/j.ijfoodmicro.2019.05.002
GRAM, C. 1884. The differential staining of Schizomycetes in tissue sections and in dried preparations. Fortschritte der Medizin. 2,185-9. Disponible desde Internet en:https://web.archive.org/web/20160610220109/http://www.asmusa.org/ccLibraryFiles/FILENAME/0000000235/1884p215.pdf (con acceso el 28/02/2023).
Herrera-Rocha, F., Cala, M.P., Aguirre-Mejía, J.L., Rodríguez-López, C.M., Chica, M.J., Olarte, H.H., ... & Gonzalez-Barrios, A.F. 2021. Dissecting fine-flavor cocoa bean fermentation through metabolomics analysis to break down the current metabolic paradigm. Sci. Rep. 11(1),1-18. https://doi.org/10.1038/s41598-021-01427-8
ICONTEC (Instituto Colombiano de Normas Técnicas y Certificación). 2009. NTC 3929. Análisis sensorial. Metodología. Métodos del perfil del sabor. ICONTEC. COL. https://tienda.icontec.org/gp-analisis-sensorial-metodologia-metodos-del-perfil-del-sabor-ntc3929-2021.html
ICONTEC (Instituto Colombiano de Normas Técnicas y Certificación). NTC 1252.Cacao en grano. Especificaciones y requisitos de calidad. ICONTEC. COL. https://tienda.icontec.org/gp-cacao-en-grano-especificaciones-y-requisitos-de-calidad-ntc1252-2021.html
ICONTEC (Instituto Colombiano de Normas Técnicas y Certificación). 2004. NTC 5278. Análisis Sensorial. Metodología. Análisis Secuencial. ICONTEC. COL. https://tienda.icontec.org/gp-analisis-sensorial-metodologia-analisis-secuencial-ntc5278-2004.html
ICONTEC (Instituto Colombiano de Normas Técnicas y Certificación). 2012. NTC 3501. Análisis Sensorial. Vocabulario. ICONTEC. COL. https://tienda.icontec.org/gp-analisis-sensorial-vocabulario-ntc3501-2012.html
ICONTEC (Instituto Colombiano de Normas Técnicas y Certificación). 2020. GTC 232. Análisis sensorial. Metodología. Guía general para el establecimiento de un perfil sensorial. ICONTEC. COL. https://tienda.icontec.org/gp-analisis-sensorial-metodologia-guia-general-para-el-establecimiento-de-un-perfil-sensorial-gtc232-2020.html
ICONTEC (Instituto Colombiano de Normas Técnicas y Certificación). 2017.GTC 280. Análisis sensorial. Directrices para la selección, entrenamiento y seguimiento de evaluadores sensoriales seleccionados y expertos. ICONTEC. COL. https://tienda.icontec.org/gp-analisis-sensorial-directrices-para-la-seleccion-entrenamiento-y-seguimiento-de-evaluadores-sensoriales-seleccionados-y-expertos-gtc280-2017.html
ICONTEC (Instituto Colombiano de Normas Técnicas y Certificación). 2014. GTC 165. Análisis sensorial. Metodología. Guía general. ICONTEC. COL. https://tienda.icontec.org/gp-analisis-sensorial-metodologia-guia-general-gtc165-2014.html
ICONTEC (Instituto Colombiano de Normas Técnicas y Certificación). 2009. GTC 3929. Análisis sensorial. Metodología. Métodos del perfil del sabor. ICONTEC. COL. https://tienda.icontec.org/gp-analisis-sensorial-metodologia-metodos-del-perfil-del-sabor-ntc3929-2021.html
Jaimes-Suárez, Y.Y., Agudelo, G.A., Báez-Daza, E. Y., Rengifo-Estrada, G.A., & Rojas-Molina, J. 2021. Modelo productivo para el cultivo de cacao (Theobroma cacao L.) en el departamento de Santander. Corporación Colombiana de Investigación Agropecuaria - AGROSAVIA. Disponible desde Internet en: https://doi.org/10.21930/agrosavia.model.7404647
Jaimez, R.E., Barragan, L., Fernández-Niño, M., Wessjohann, L.A., Cedeño-Garcia, G., Cantos, I.S., & Arteaga, F. 2022. Theobroma cacao L. cultivar CCN 51: a comprehensive review on origin, genetics, sensory properties, production dynamics, and physiological aspects. PeerJ. 9, e12676. https://doi.org/10.7717/PEERJ.12676/FIG-3
Lefeber, T., Janssens, M., Camu, N., & De Vuyst, L. 2010. Kinetic analysis of strains of lactic acid bacteria and acetic acid bacteria in cocoa pulp simulation media toward development of a starter culture for cocoa bean fermentation. Appl Environ. Microbiol.76(23),7708-7716. https://doi.org/10.1128/AEM.01206-10
López-Suárez A, F., González, A., Herrera, F., & Reyes, A. 2021. Análisis metataxonómico de la fermentación espontánea de cacao de fino aroma en dos granjas industriales, Colombia. Estudio de caso. Departamento de Ingeniería Química y de Alimentos. Departamento de Ciencias Biológicas, Universidad de los Andes. https://repositorio.uniandes.edu.co/bitstream/handle/1992/51669/23495.pdf?sequence=1
Llerena, K., & Uriña, Z. (2017). Uso de cultivos iniciadores (Starter) en la fermentación de Cacao tipo nacional clon 103 y CCN-51 en la estación Pichilingue ubicada en Quevedo-Provincia de los Ríos. [Tesis Pregrado, Universidad de Guayaquil]. Biblioteca virtual: http://repositorio.ug.edu.ec/bitstream/redug/28030/1/TESIS-FINAL-MARZO.pdf
Machuca-Guevara, J.I., Suárez-Peña, E.A., Motte-Darricau, E., & Mialhe-Matonnier, E.L. 2019. Caracterización molecular de los microorganismos presentes durante el proceso fermentativo de los granos de cacao (Theobroma cacao). Rev. Perú. Biol. 26(4),535-542. http://dx.doi.org/10.15381/rpb.v26i4.17220
Mendoza-Salazar, M.M., Álvarez, O.L.M., Castañeda, M.P.A., & Medina, P.X.L. 2022. Bioprospecting of indigenous yeasts involved in cocoa fermentation using sensory and chemical strategies for selecting a starter inoculum. Food Microbiol. 101,103896.https://doi.org/10.1016/j.fm.2021.103896
Ministerio De La Protección Social (15 de febrero de 2011). Resolución 333 del 2011 Numeral 9.3. Por la cual se establece el reglamento técnico sobre los requisitos de rotulado o etiquetado nutricional que deben cumplir los alimentos envasados para consumo humano. Disponible desde Internet en: https://scj.gov.co/sites/default/files/marco-legal/R_MPS_0333_2011.pdf (con acceso el 01/03/2023).
Muyzer, G., De Waal, E. C., & Uitterlinden, A. (1993). Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA. Appl. Environ. Microbiol. 59(3), 695-700. https://doi.org/10.1128/aem.59.3.695-700.1993
Lima, C.O.D.C., Vaz, A.B., De Castro, G.M., Lobo, F., Solar, R., Rodrigues, C., ... & Góes-Neto, A. 2021. Integrating microbial metagenomics and physicochemical parameters and a new perspective on starter culture for fine cocoa fermentation. Int. J. Food Microbiol. 93,103608. https://doi.org/10.1016/j.fm.2020.103608
Ordoñez-Araque, R.H., Landines-Vera, E.F., Urresto-Villegas, J.C., & Caicedo-Jaramillo, C.F. 2020. Microorganisms during cocoa fermentation: Systematic review. Foods Raw Mater. 8(1),155-162. http://doi.org/10.21603/2308-4057-2020-1-155-162
Ostovar, K., & Keeney, P.G. 1973. Isolation and characterization of microorganisms involved in the fermentation of Trinidad's cacao beans. Journal of Food Science. 38(4), 611-617. https://doi.org/10.1111/j.1365-2621.1973.tb02826.x
Ouattara, H. G., & Niamké, S. L. 2021. Mapping the functional and strain diversity of the main microbiota involved in cocoa fermentation from Cote d’Ivoire. Food Microbiol. 98, 103767. https://doi.org/10.1016/j.fm.2021.103767
Perez, M., Lopez-Yerena, A., & Vallverdú-Queralt, A. 2021. Traceability, authenticity and sustainability of cocoa and chocolate products: a challenge for the chocolate industry. Crit. Rev. Food Sci. Nutr.62(2),475-489. https://doi.org/10.1080/10408398.2020.1819769
Quintana-Fuentes, L.F., García Jerez, A., & Moreno Martínez, E. 2018. Perfil sensorial de cuatro modelos de siembra de cacao en Colombia. Entramado.14(2), 256-268. https://doi.org/10.18041/1900-3803/ENTRAMADO.2.4756
Rai, A. K., Pandey, A., & Sahoo, D. 2019. Biotechnological potential of yeasts in functional food industry. rends Food Sci. Technol. 83,129-137. https://doi.org/10.1016/j.tifs.2018.11.016
Rivera, G. 2017. Estudio de la actividad microbiana durante el proceso de fermentación en hìbridos de cacao (Theobroma cacao L.) mediante la adición de musáceas. Proyecto de investigación, Universidad Técnica Estatal de Quevedo, Ecuador. https://repositorio.uteq.edu.ec/bitstream/43000/2074/1/T-UTEQ-0061.pd
Rodrigo-Torres, L., Yépez, A., Aznar, R., & Arahal, D. R. 2019. Genomic insights into five strains of Lactobacillus plantarum with biotechnological potential isolated from chicha, a traditional maize-based fermented beverage from Northwestern Argentina. Front. Microbiol. 10, 2232. https://doi.org/10.3389/fmicb.2019.02232
Rojas-Molina, J., Ortiz-Cabralez, L., Escobar-Pachajoa, L., Rojas-Buitrago, M., & Jaimes-Suarez, Y. 2021. Descomposición y liberación de nutrientes en biomasa por poda de cacao (Theobroma cacao L.) en Rionegro, Santander, Colombia. Agron. Mesoam. 32(3), 888-900. https://doi.org/10.15517/am.v32i3.41608
Scalone, G. L. L., Textoris-Taube, K., De Meulenaer, B., De Kimpe, N., Wöstemeyer, J., & Voigt, J. 2019. Cocoa-specific flavor components and their peptide precursors. Int. Food Res. J. 123,503-515. https://doi.org/10.1016/J.FOODRES.2019.05.019
Schwan, R.F., & Wheals, A.E. 2004. The microbiology of cocoa fermentation and its role in chocolate quality. Crit. Rev. Food Sci. Nutr. 44(4), 205-221. https://doi.org/10.1080/10408690490464104
Sinche-Bósquez, P.D. (2013). Evaluación de los tiempos de Fermentación con la Adición de la Enzima Polifenol Oxidasa y Levadura Saccharomyces Cerevisiae para mejorar las características de Calidad (Aroma y Sabor) del cacao CCN-51 en la UTE Santo Domingo. [Tesis Pregrado, Tecnológica Equinoccial]. Biblioteca virtual: http://192.188.51.77/bitstream/123456789/19126/1/6884_1.pdf
Swings, J. (1993). The genera Acetobacter and Gluconobacter. In: A. Balows, H.G. Triiper, W. Harder & K.H. Schleifer. In The Prokaryotes, a handbook on the biology of bacteria, ecophysiology, isolation, identification and applications. (pp. 2268-2286). Editions Springer Verlag.
Swings, J. (1993). The genera Acetobacter and Gluconobacter. In The Prokaryotes, a handbook on the biology of bacteria, ecophysiology, isolation, identification and applications (2nd Edition. Vol. Ill Chapter 111, pp. 2268-2286(A. Balows, H.G. Triiper, M. Dworkin, W. Harder and K.H. Schleifer, Eds.); Springer Verlag.
Techo, S., Shiwa, Y., Tanaka, N., Fujita, N., Miyashita, M., Shibata, C., ... & Tanasupawat, S. 2019. Enterococcus florum sp. nov., isolated from a cotton flower (Gossypium hirsutum L.). Int. J. Syst. Evol. Microbiol. 69(8), 2506-2513. https://doi.org/10.1099/ijsem.0.003524
Vázquez-Ovando, A., Ovando-Medina, I., Adriano-Anaya, L., Betancur-Ancona, D., & Salvador-Figueroa, M. 2016. Alcaloides y polifenoles del cacao, mecanismos que regulan su biosíntesis y sus implicaciones en el sabor y aroma. Arch. Latinoam. Nutr. 66(3), 239-254.
Warren, A.J., Kumari, N., Böttcher, N.L., Kouame, J.K., Koffi, J., Grimbs, S., Vrancken, G., ... & Ullrich, M.S. 2016. Aseptic artificial fermentation of cocoa beans can be fashioned to replicate the peptide profile of commercial cocoa bean fermentations. Food.Res.Int. 89,764-772. https://doi.org/10.1016/j.foodres.2016.10.011
White, T.J., T. Bruns, S. Lee, & J.W. Taylor. (1990). Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. Pp. 315-322 In: PCR Protocols: A Guide to Methods and Applications, eds. Innis, M.A., D.H. Gelfand, J.J. Sninsky, and T.J. White. Academic Press, Inc., New York.
Yang, H., Chen, T., Wang, M., Zhou, J., Liebl, W., Barja, F., & Chen, F. 2022. Molecular biology: Fantastic toolkits to improve knowledge and application of acetic acid bacteria. Biotechnol. Adv. 107911. https://doi.org/10.1016/j.biotechadv.2022.107911

