Artículos
Presencia de Bipolaris cookei en sorgo en el centro oeste de Entre Ríos, Argentina
Occurrence of Bipolaris cookei on sorghum in central-western Entre Ríos, Argentina
Revista FAVE Sección Ciencias Agrarias
Universidad Nacional del Litoral, Argentina
ISSN: 2346-9129
ISSN-e: 2346-9129
Periodicidad: Semestral
vol. 22, 2023
Recepción: 19 Diciembre 2022
Aprobación: 29 Marzo 2023

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.
Resumen: En la provincia de Entre Ríos, Argentina, el sorgo se cultiva con destino a grano y forraje, contribuyendo además en los sistemas productivos a mantener la estabilidad estructural del suelo. En verano de 2018, en dos híbridos comerciales de sorgo granífero implantados en la EEA Paraná del INTA (Oro Verde, Entre Ríos), se observaron manchas foliares castaño oscuras, elípticas a ovaladas, regulares a algo irregulares, a veces con márgenes difusos, de 3 x 5 mm aproximadamente, en los estratos medio e inferior de las plantas. Asimismo, en verano de 2019, en dos híbridos pre comerciales y en un híbrido comercial, además de los síntomas anteriormente mencionados, se detectaron puntuaciones y manchas púrpuras con márgenes irregulares y difusos y delimitadas por las nervaduras en las hojas más jóvenes, dando el aspecto de un “salpicado” foliar. El objetivo del trabajo fue caracterizar e identificar el organismo causal de una enfermedad foliar presente en híbridos de sorgo granífero del centro oeste de Entre Ríos. Los síntomas observados en las muestras provenientes de campo y los producidos en las pruebas de patogenicidad, las características morfológicas de las colonias, así como la de los conidios desarrollados in vivo e in vitro, coincidieron con las descripciones realizadas para Bipolaris cookei (= B. sorghicola), organismo causal de la “mancha por Bipolaris” o “mancha difusa” del sorgo. La información obtenida contribuye al conocimiento de este patosistema en la región productora de sorgo de Entre Ríos.
Palabras clave: Sorghum, enfermedad, hongo, etiología.
Abstract: In the province of Entre Ríos, Argentina, sorghum is grown for grain and forage, and also contributes to maintaining soil structural stability in production systems. In summer 2018, in two commercial hybrids of grain sorghum planted at the Paraná Agricultural Experimental Station of INTA (Oro Verde, Entre Ríos), dark brown, elliptical to oval, regular to somewhat irregular leaf spots, sometimes with diffuse margins, measuring approximately 3 x 5 mm, were observed in the middle and lower strata of the plants. Also, in summer 2019, on two pre-commercial hybrids and one commercial hybrid, in addition to the symptoms mentioned above, specks and purple spots with irregular and diffuse margins and delimited by the veins were detected on the youngest leaves, giving the appearance of a foliar "splash". The objective of this work was to characterize and identify the causal organism of a foliar disease present in grain sorghum hybrids from central-western Entre Ríos. The symptoms observed in field samples and those produced in pathogenicity tests, the morphological characteristics of the colonies, as well as those of the conidia developed in vivo and in vitro, coincided with the descriptions made for Bipolaris cookei (= B. sorghicola), the causal organism of the "target leaf spot" of sorghum. The information obtained contributes to the knowledge of this pathosystem in the sorghum producing region of Entre Ríos.
Keywords: Sorghum, disease, fungus, etiology.
Introducción
El sorgo (Sorghum spp.) es un cereal que en Argentina se cultiva para grano y forraje, contribuyendo además en los sistemas productivos a mantener la estabilidad estructural del suelo. La superficie sembrada en Argentina en el ciclo agrícola 2021/22 fue de 1.000.000 ha, con una producción final de 3.500.000 t (Bolsa de Cereales de Buenos Aires, 2022). En la provincia de Entre Ríos, el total implantado fue de 120.000 ha, del cual el 59 % (70.700 ha) correspondió a sorgo granífero y el 41 % restante (49.300 ha), a sorgos forrajeros, sileros o doble propósito. Los principales departamentos productores fueron Nogoyá, Paraná, Villaguay, La Paz, Tala y Gualeguay, que concentraron el 63 % del total producido (269.390 t) (SIBER, 2022).
A finales de enero de 2018, en el híbrido de sorgo granífero (S. bicolor) Takurí implantado en la Estación Experimental Agropecuaria Paraná del Instituto Nacional de Tecnología Agropecuaria (INTA), Oro Verde, Entre Ríos (31° 51’ 00,75” S - 60° 31’ 27,58” O), se observaron plantas en el estado fenológico 6 (mitad de floración), según la escala fenológica de Vanderlip (1993), con manchas foliares en el 25 % de las mismas. Estas, de color castaño oscuras, elípticas a ovaladas, regulares a algo irregulares, a veces con márgenes difusos, de 3 x 5 mm aproximadamente, se situaron en los estratos medio e inferior de las plantas (Figura 1a). En el siguiente ciclo agrícola (2018/19), a principios de diciembre de 2018 y en el mismo sitio, en el híbrido granífero Atacama 70 M en el estado fenológico 2 (5 hojas completamente expandidas) se detectaron síntomas como los anteriormente descritos, además de puntuaciones y manchas púrpuras con márgenes irregulares y difusos, delimitadas por las nervaduras en las hojas más jóvenes, dando el aspecto de un “salpicado” (Figura 1b), en el 80 % de las plantas. Asimismo, a principios de febrero de 2019, en dos híbridos pre comerciales y en el híbrido Takurí, nuevamente se observaron los síntomas previamente descritos en el 15-25 % de las plantas.
Las observaciones preliminares permitieron identificar como organismo causal de estos síntomas a un hongo con características similares para el género Bipolaris (Ascomycota) (Manamgoda et al., 2014).
El objetivo del trabajo fue caracterizar e identificar el organismo causal de una enfermedad foliar presente en híbridos de sorgo granífero del centro oeste de Entre Ríos.

FIGURA 1 / FIGURE 1
Síntomas foliares en sorgo granífero en los híbridos Takurí (a) y Atacama 70 M (b) / Foliar symptoms in graniferous sorghum in the hybrids Takurí (a) and Atacama 70 M (b).
Materiales y métodos
El trabajo se realizó en el Laboratorio de Patología Vegetal de la EEA Paraná del INTA.
Aislamiento y cultivo del agente etiológico
Secciones de hojas con síntomas de aproximadamente 10 x 5 mm, extraídas de uno de los híbridos pre comerciales, se desinfestaron sucesivamente con alcohol 70° durante 30 segundos e hipoclorito de sodio 1 % durante 1 minuto, se enjuagaron con agua destilada estéril y se secaron en cámara de flujo laminar. Para favorecer el desarrollo de posibles estructuras fúngicas, el material desinfestado se colocó en cámaras húmedas a 26 ± 1 °C durante 48 horas y con alternancia de 12 horas de luz blanca fluorescente y 12 horas de oscuridad. Una vez detectados los conidios, se sembraron en agar papa glucosado acidificado (APG Ac) con ácido láctico al 25 % (pH = 5,5). La incubación se realizó bajo las mismas condiciones utilizadas para las cámaras húmedas. Las colonias fúngicas obtenidas se repicaron en agar papa glucosado común (APG) hasta la obtención de aislamientos puros, los cuales se conservaron a 4 °C para pruebas posteriores.
Caracterización del agente etiológico
Además de considerar la morfología y el color de los conidios, se determinaron valores biométricos como largo y ancho, número de tabiques transversales o distoseptos y ancho del hilio. Para ello, se observaron conidios obtenidos de tejidos vegetales enfermos colocados 48 horas en cámara húmeda, así como de colonias de 14 días desarrolladas en APG y agar harina de maíz (AHM) a 26 ± 1 °C y oscuridad, empleando un microscopio óptico con una magnificación total de 400 X. Los valores biométricos se determinaron con el programa MICAM (2020), a partir de fotografías obtenidas directamente del microscopio.
Las características de las colonias fúngicas, como morfología, color, diámetro y tasa diaria de crecimiento, se determinaron sobre colonias desarrolladas en cajas de Petri conteniendo APG (n = 3) y AHM (n = 4). Para tal fin, en el centro de cada una se inoculó con el hongo y se incubó a 26 ± 1 °C y en oscuridad. El diámetro de cada colonia se determinó a los 3, 5, 7, 10, 13, 14, 17, 19, 21, 24 y 26 días desde la inoculación, considerando su margen de avance, según la metodología descrita por Hebert y French (1980). Con los valores obtenidos, se calculó la tasa diaria de crecimiento.
La germinación bipolar de conidios es una de las características que permite diferenciar Bipolaris de otros géneros pertenecientes a la misma familia, como Exserohilum y Drechslera (Piontelli Laforet, 2015; Silva et al., 2006). El género Bipolaris se caracteriza porque sus conidios, además de originar el tubo germinativo en uno de sus polos, también lo hacen en ambos: uno desde el ápice y el otro, cercano a la cicatriz (Manamgoda et al., 2014; Sivanesan, 1987; Tarr, 1962). Con el objetivo de inducir este proceso se utilizó la metodología descrita por Piontelli Laforet (2015) empleando una solución nutritiva. Para ello, en un portaobjeto de vidrio con centro cóncavo, se colocó una gota de agua destilada estéril en la cual se disolvió una pequeña cantidad de glucosa en polvo. A continuación, se sembraron conidios provenientes de una colonia pura del hongo, se cubrió con cubreobjeto y se colocó en el interior de una caja de Petri incubando en estufa a 26 ± 1 °C, en oscuridad durante 18 horas. Las observaciones se realizaron sobre 100 conidios con un microscopio óptico a 400 X.
La esporulación secundaria de conidios, o conidiogénesis secundaria, es un proceso que ocurre en ciertas especies del género Bipolaris, principalmente bajo condiciones artificiales de cultivo. En B.cookei (= B. sorghicola) es muy frecuente, siendo esta la única especie descrita como patógena para Sorghum spp. que presenta dicho proceso (Manamgoda et al., 2014), considerado además como su carácter más distintivo (Ahmed y Ravinder Reddy, 1993). Con la finalidad de comprobar la existencia de este tipo de esporulación, se realizó la observación in situ de conidios producidos en tejidos vegetales enfermos colocados previamente en cámara húmeda, así como en colonias desarrolladas sobre APG, AHM y agar agua 2 % (AA). Este último medio se seleccionó considerando la metodología propuesta por Petrović et al. (1998) para inducir la germinación de conidios de B. cookei. Las colonias en AA se obtuvieron colocando conidios provenientes de una colonia pura del hongo en 6 cajas de Petri conteniendo el medio e incubando durante 11 días bajo las mismas condiciones utilizadas para APG y AHM. En todos los casos, las observaciones se realizaron directamente, bajo microscopio estereoscópico.
Pruebas de patogenicidad
Con la finalidad de cumplir con los postulados de Koch, se realizaron dos pruebas de patogenicidad con el organismo aislado.
Método del disco de agar: Esta prueba se basó en la metodología descrita por Cúndom et al. (2013). Se utilizaron plantas sanas del híbrido Takurí con 2 hojas expandidas (45 días después de la siembra). Estas se obtuvieron en invernáculo, en macetas plásticas de 3 litros con tierra fértil, con 5 semillas cada una, totalizando 10 macetas (5 macetas y 25 plantas por tratamiento). Previamente, las semillas se desinfectaron con hipoclorito de sodio 1 % durante 2 minutos y se enjuagaron 3 veces con agua destilada estéril. Como fuente de inóculo se utilizaron porciones de 0,5 x 0,5 mm de medio de cultivo APG con micelio y estructuras reproductivas del hongo obtenidas de colonias de 18 días. La inoculación se realizó colocando el inóculo sobre la superficie adaxial de 2 hojas por planta. Cada sitio de inoculación se cubrió con un trozo de film de polietileno tipo stretch a los fines de favorecer el contacto del hongo con el tejido vegetal y evitar la desecación del medio de cultivo. En el tratamiento testigo se colocó medio APG estéril. Posteriormente, cada maceta se cubrió con una bolsa de polietileno ligeramente humedecida en su interior y se dejó bajo las mismas condiciones que las utilizadas para el crecimiento del hongo. A los 3 días se extrajeron los trocitos o segmentos de inóculo con los films y se continuó con las condiciones de cámara húmeda para favorecer el desarrollo posterior del hongo. Las características de los conidios (forma, color y valores biométricos) se determinaron a los 22 días.
Método de pulverización: Esta prueba se basó en la metodología indicada por Petrović et al. (1998). Las inoculaciones se realizaron sobre plantas sanas del híbrido TOB 62 T con 2 hojas expandidas (28 días después de la siembra) obtenidas en macetas plásticas de 1 litro con tierra fértil con 9 semillas en cada una, totalizando 6 macetas (3 macetas y 27 plantas por tratamiento). Las mismas permanecieron a 26 ± 1 °C y fotoperíodo de 12 horas de luz y 12 horas de oscuridad hasta el momento de la inoculación. Previamente, se extrajeron plantas para utilizar 5 por maceta (15 plantas por tratamiento). Como fuente de inóculo se utilizó una colonia de 9 días crecida sobre APG a 26 ± 1 °C y en oscuridad. El contenido de una caja de Petri (medio, micelio y estructuras reproductivas del hongo) se desmenuzó manualmente, se adicionaron 50 ml de agua destilada estéril, se mezcló con agitador magnético durante 30 minutos y el líquido resultante se asperjó sobre 15 plantas (3 macetas y 5 plantas por maceta) utilizando un pulverizador manual. El tratamiento testigo consistió en pulverizar una mezcla de medio APG sin el hongo, más agua destilada estéril, sobre el mismo número de plantas. Posteriormente, cada maceta se cubrió con una bolsa de polietileno ligeramente humedecida en su interior por 48 horas y se dejó bajo las mismas condiciones que las utilizadas para el crecimiento de las colonias del hongo. A los 15 días desde la inoculación, se extrajeron los tejidos enfermos, se desinfectaron y se procedió a la realización de cámaras húmedas y siembras en APG. Las características morfométricas de los conidios se determinaron a los 20 días.
En ambas pruebas, las observaciones se realizaron diariamente cada 24 horas después de la inoculación. A partir de los síntomas logrados se procedió al reaislamiento del hongo inoculado de acuerdo a la metodología empleada para el aislamiento inicial.
Los valores biométricos obtenidos se analizaron con el paquete InfoStat v. 2020 (Di Rienzo et al., 2020) para obtener las siguientes medidas resumen: número de observaciones (n), media, valor mínimo (Min), valor máximo (Max) y desviación estándar (D.E.).
Resultados y discusión
Los síntomas observados en los híbridos de sorgo bajo condiciones de campo fueron similares a los descritos para la enfermedad denominada “target leaf spot”, “mancha alvo”, “mancha por Bipolaris” o “mancha difusa”, ocasionada por B. cookei (Da Silva Ferreira et al., 2007; Espíndola et al., 2017; Tarr, 1962). Las lesiones más antiguas a menudo muestran bandas claras y oscuras alternas con un centro claro, lo que produce el típico patrón zonado (Tarr, 1962), característica ésta que no se observó en el presente trabajo.
Aislamiento y caracterización del agente etiológico
Los tejidos con síntomas, provenientes de campo y colocados en cámara húmeda, desarrollaron abundante micelio conteniendo conidióforos simples, solitarios o en pequeños grupos de 2-4, rectos o curvos, multiseptados, grises a oliváceo-oscuros, con la base engrosada y un ápice geniculado. En el extremo apical de los conidióforos se observaron conidios solitarios o en grupos de 2-3, grisáceos a oliváceo-claros, ligeramente curvos a rectos (Figura 2); la lectura de conidios permitió determinar las siguientes medidas: 63,4 (31,0-94,0 ± 10,7) µm de largo por 12,8 (9,3-16,1 ± 1,1) µm de ancho, con 6 (3-8) distoseptos y un hilio de 3,0 (2,5-3,3 ± 0,3) µm de ancho. Los conidios obtenidos en las colonias crecidas en APG midieron 58,8 (34,9-100,0 ± 13,2) µm de largo por 13,1 (10,2-16,5 ± 1,3) µm de ancho, presentaron 5 (3-7) distoseptos y un hilio de 3,0 (2,3-3,7 ± 0,3) µm de ancho. En AHM, los conidios midieron 58,9 (33,6-89,0 ± 11,1) µm de largo por 13,4 (11,3-16,0 ± 1,0) µm de ancho, con 5 (3-8) distoseptos y un hilio de 3,0 (2,2-3,8 ± 0,4) µm de ancho. El tamaño y otras características morfológicas de los conidios obtenidos tanto de los tejidos con síntomas como los desarrollados sobre los medios de cultivo, fueron similares a las citadas para B. cookei (Acciaresi y Mónaco, 1999; Cúndom et al., 2013;Manamgoda et al., 2014; Petrović et al., 1998; Sivanesan, 1987; Tarr, 1962; Yi et al., 2001). Bajo condiciones de campo, cada conidióforo de B. cookei origina comúnmente 1-2 conidios, pero en cámara húmeda su producción es más abundante (Tarr, 1962), lo cual se verificó en este trabajo empleando la metodología anteriormente indicada.
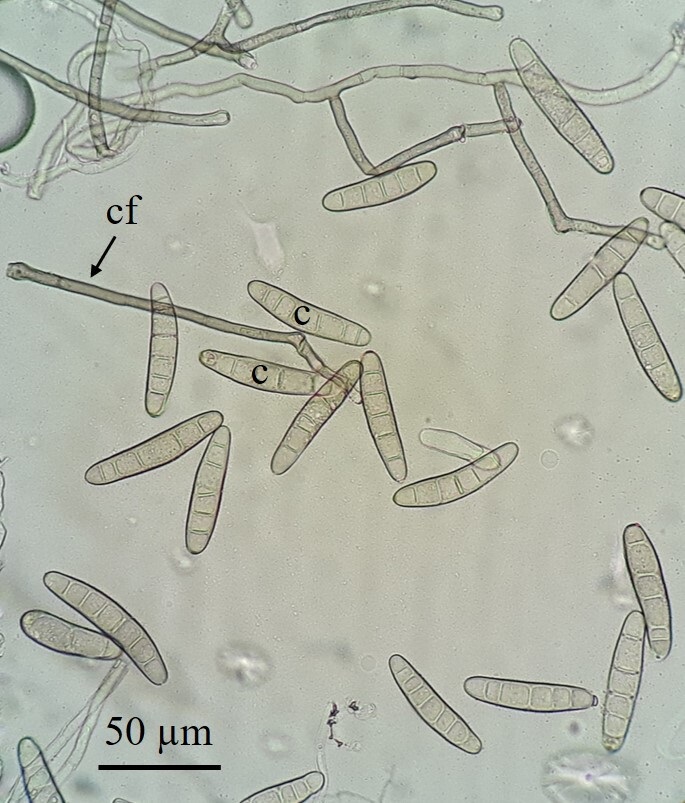
FIGURA 2 / FIGURE 2
Conidios (c) y conidióforos (cf) obtenidos de una mancha foliar luego de 48 horas de cámara húmeda / Conidia (c) and conidiophores (cf) obtained from a leaf spot after 48 hours of moist chamber.
Las colonias fúngicas en APG se caracterizaron por ser compactas, con contornos irregulares, aspecto algodonoso, abundante micelio aéreo, gris-oscuras, con áreas aterciopeladas negruzcas y escasa esporulación (Figura 3a). En AHM, las colonias fueron delgadas, con micelio escaso, grisáceas, con contornos lobulados negruzcos, abundante producción de conidióforos y conidios, principalmente en los márgenes (Figura 3b). El crecimiento de las colonias en APG y AHM fue lento, con un diámetro final de 38,3 (34,5-42,5 ± 4,0) y 47,5 (39,0-52,0 ± 5,8) mm, y una tasa de crecimiento de 1,4 (1,1-2,0 ± 0,3) y 1,4 (1,0-1,7 ± 0,2) mm día-1, respectivamente. Las descripciones de las colonias desarrolladas tanto sobre APG como en AHM coincidieron con las realizadas por diversos autores para B.cookei (Acciaresi y Mónaco, 1999; Cúndom et al., 2013; Manamgoda et al., 2014; Petrović et al., 1998; Sivanesan, 1987; Tarr, 1962).
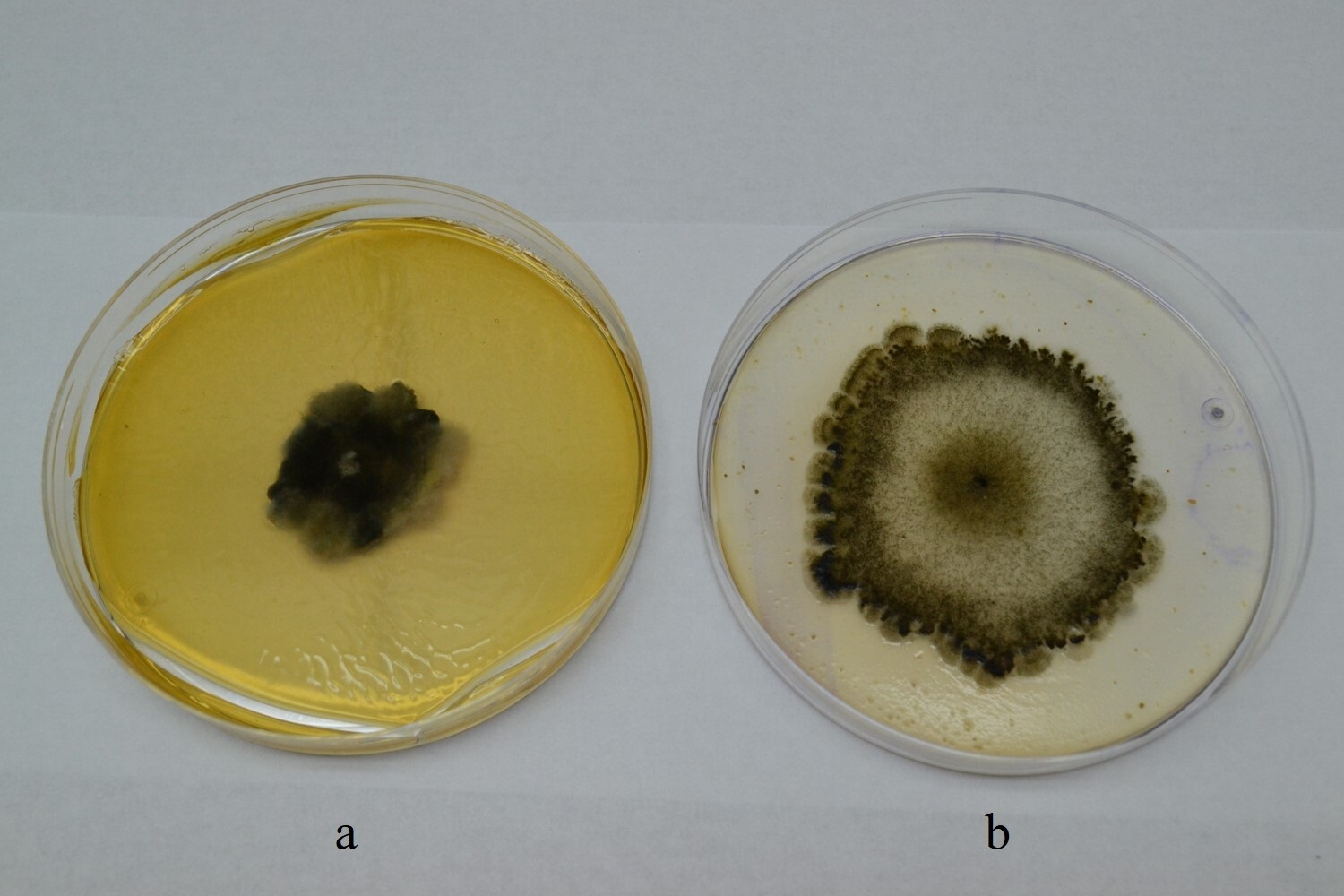
FIGURA 3 / FIGURE 3
Colonias de 14 días de edad en APG (a) y AHM (b) / 14-day-old colonies in potato dextrose agar (PDA) (a) and corn meal agar (CMA) (b).
La prueba de germinación de los conidios evidenció que el 65 % emitió tubos germinativos por ambos polos (Figura 4a), el 26 % solo por uno de ellos (Figura 4b), el 3 % por su parte lateral y por uno o ambos polos (Figura 4c); el 6 % restante no germinó. La germinación bipolar es una característica particular de los conidios de B. cookei (Cúndom et al., 2013; Manamgoda et al., 2014; Petrović et al., 1998; Tarr, 1962). Acciaresi y Mónaco (1999) observaron, además, la germinación lateral en muy baja frecuencia al igual que en el presente trabajo.
La metodología desarrollada permitió confirmar el proceso de esporulación secundaria mediante la observación de conidióforos y conidios secundarios sobre conidios primarios desarrollados en AA (Figura 4d), no así en los otros medios utilizados para el estudio de las colonias (APG y AHM). Además de observarse en medios de cultivo (Manamgoda et al., 2014), la esporulación secundaria de B.cookei también puede ocurrir en conidios desarrollados sobre tejidos foliares enfermos colocados en cámara húmeda (Tarr, 1962), lo cual no se observó en este trabajo. La esporulación secundaria ocurre cuando un conidio primario que está adherido a su conidióforo germina para originar un conidióforo secundario que a su vez produce conidios (Sivanesan, 1987; Tarr, 1962). En este caso, el tubo germinativo de un conidio (primario) se convierte en un conidióforo secundario productor de conidios secundarios. Si bien no se realizaron mediciones de los conidióforos y conidios secundarios observados, los mismos presentaron un menor tamaño en relación a los conidióforos y conidios primarios, coincidiendo con lo expresado por Tarr (1962) y Ahmed y Ravinder Reddy (1993). B. cookei puede ser detectado además sobre semillas de sorgo en pruebas de incubación; en este caso, el hongo crece sobre la semilla y presenta frecuentemente esporulación secundaria (Ahmed y Ravinder Reddy, 1993). En Argentina, los únicos estudios de caracterización del patógeno fueron llevados a cabo por Acciaresi y Mónaco (1999) y Cúndom et al. (2013), sin hacer referencia a este tipo de esporulación.
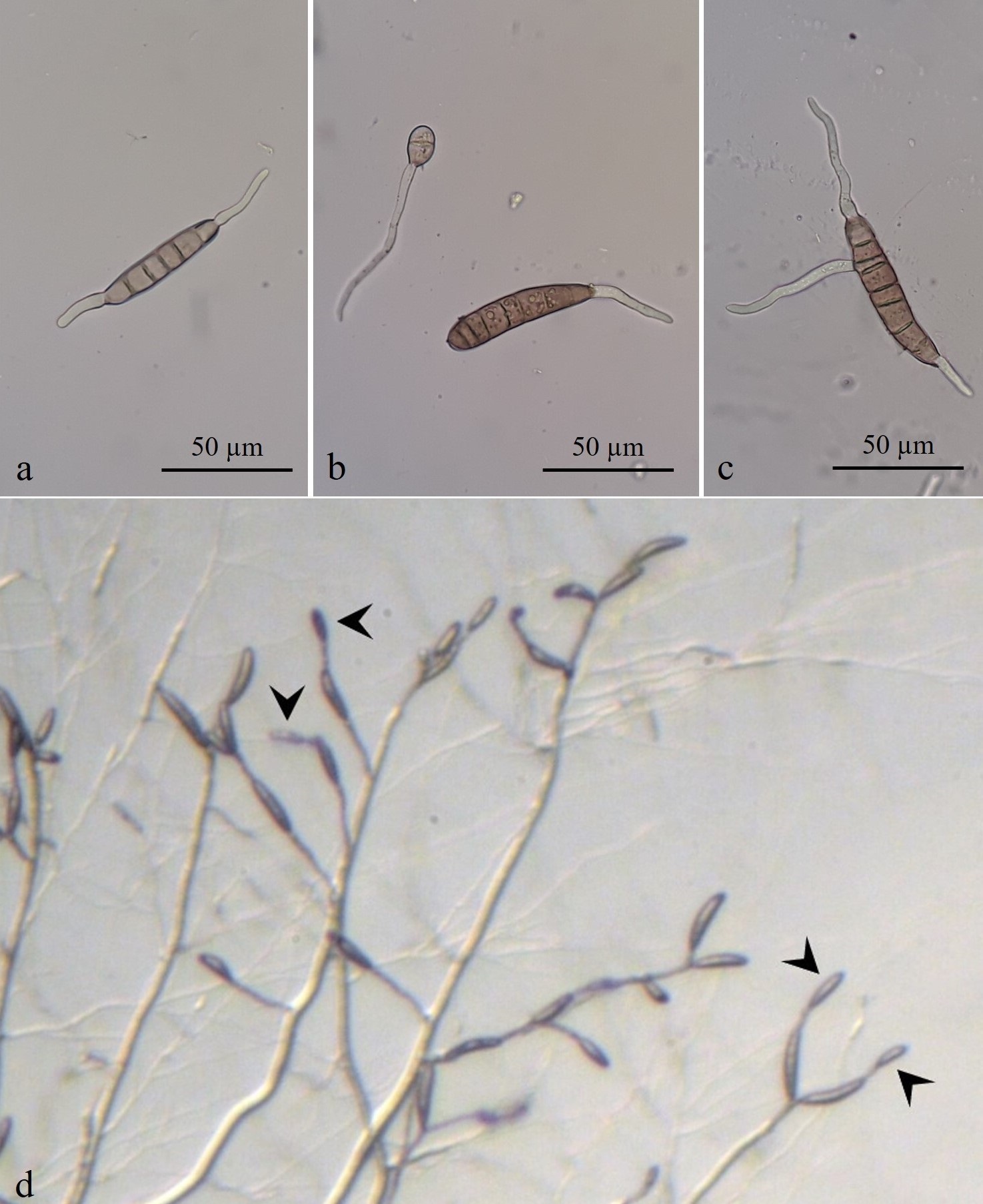
FIGURA 4 / FIGURE 4
Conidios con germinación bipolar (a), polar (b) y bipolar y lateral (c). Esporulación secundaria (d): conidios secundarios (flechas) originados de conidios primarios en una colonia de 11 días de edad en agar agua (AA) 2 % / Conidia with bipolar (a), polar (b) and bipolar and lateral (c) germination. Secondary sporulation (d): secondary conidia (arrows) originating from primary conidia in an 11-day-old colony in water agar (WA).
Además de B. cookei, B. halepensis es citada como patógena en Sorghum spp. a nivel mundial. La misma no se encuentra presente en nuestro país (SINAVIMO, 2022), estando descrita por el momento solo en USA donde ocasiona manchas foliares en sorgo de Alepo (S.halepense) (Farr y Rossman, 2022). Esta especie se diferencia morfológicamente de B. cookei por el mayor tamaño de los conidios (60-110 x 13-19 µm) y un número superior de distoseptos (4-12), además de no presentar esporulación secundaria (Manamgoda et al., 2014).
Pruebas de patogenicidad
Método del disco de agar: A los 4 días de la inoculación, se observaron lesiones irregulares, rojizas a púrpuras y con pequeñas áreas necróticas castaño-claras que ocuparon casi todo el ancho de la lámina foliar. Con el transcurrir de los días se detectaron nuevos síntomas (Figura 5a), producto de infecciones secundarias, consistentes en manchas alargadas, paralelas a las nervaduras, difusas, de coloración rojiza que se tornaban más oscuras a medida que transcurría el tiempo (Figura 5b). En las plantas del tratamiento testigo, no se visualizaron síntomas ni signos de la enfermedad. A los 22 días desde la inoculación, los conidios midieron 54,5 (31,6-78,0 ± 9,4) µm de largo por 12,6 (10,0-15,5 ± 1,2) µm de ancho, y presentaron 5 (3-8) distoseptos y un hilio de 3,2 (2,4-4,7 ± 0,4) µm de ancho. El hongo inoculado fue reaislado fácilmente a partir de los tejidos enfermos.
Método de pulverización: Los primeros síntomas se observaron a los 2 días después de la inoculación y consistieron en puntuaciones y manchas rojizas, las de mayor tamaño paralelas a las nervaduras (Figura 5c). Con el transcurrir de los días, las lesiones se alargaron, tomando el aspecto de bandas difusas (Figura 5d). Posteriormente, se observaron grandes áreas rojizas (Figura 5e) y atizonamiento de hojas inferiores (Figura 5f), originados probablemente por la mayor concentración de inóculo utilizada. En todos los casos, las lesiones presentaron márgenes difusos. Los conidios provenientes de tejidos inoculados, extraídos a los 20 días desde la inoculación, midieron 68,5 (35,3-94,0 ± 11,3) µm de largo por 13,4 (11,3-15,9 ± 1,0) µm de ancho, presentaron 6 (3-8) distoseptos y un hilio de 2,9 (2,2-3,4 ± 0,3) µm de ancho. Posteriormente, el hongo inoculado se reaisló sin dificultad a partir de las hojas enfermas.
A efectos comparativos, en la Tabla 1 se muestran los valores biométricos registrados en conidios procedentes de hojas de sorgo infectadas de forma natural e inoculadas artificialmente, y de los dos medios de cultivo.
Los síntomas producidos en las pruebas de patogenicidad fueron similares a los observados por Cúndom et al. (2013) para B. cookei. Estos autores además determinaron un breve período de incubación de la enfermedad, como lo hallado en el presente trabajo.

FIGURA 5 / FIGURE 5
Método del disco: síntomas a los 7 (a) y 15 (b) días de la inoculación. Las flechas negras y las elipses blancas indican lesiones originadas por la inoculación primaria y secundaria, respectivamente. Método de pulverización: síntomas a los 2 (c), 5 (d), 9 (e) y 15 (f) días de la inoculación / Disc method: symptoms at 7 (a) and 15 (b) days after inoculation. Black arrows and white ellipses indicate lesions caused by primary and secondary inoculation, respectively. Spray method: symptoms at 2 (c), 5 (d), 9 (e) and 15 (f) days after inoculation.
| Parámetro | Hojas de sorgo | Medios de cultivo | |||
| Infección natural | Prueba de inoculación | APG | AHM | ||
| Disco de agar | Pulverización | ||||
| Largo (µm) | |||||
| n | 140 | 150 | 135 | 130 | 150 |
| Media | 63,4 | 54,5 | 68,5 | 58,8 | 58,9 |
| Min - Max | 31,0 – 94,0 | 31,6 – 78,0 | 35,3 – 94,0 | 34,9 – 100,0 | 33,6 – 89,0 |
| D.E. | 10,7 | 9,4 | 11,3 | 13,2 | 11,1 |
| Ancho (µm) | |||||
| n | 140 | 150 | 135 | 130 | 150 |
| Media | 12,8 | 12,6 | 13,4 | 13,1 | 13,4 |
| Min - Max | 9,3 – 16,1 | 10,0 – 15,5 | 11,3 – 15,9 | 10,2 – 16,5 | 11,3 – 16,0 |
| D.E. | 11,1 | 1,2 | 1,0 | 1,3 | 1,0 |
| Número de distoseptos | |||||
| n | 140 | 150 | 135 | 130 | 150 |
| Media | 6 | 5 | 6 | 5 | 5 |
| Min - Max | 3 - 8 | 3 - 8 | 3 - 8 | 3 - 7 | 3 - 8 |
| Ancho del hilio (µm) | |||||
| n | 18 | 27 | 35 | 20 | 54 |
| Media | 3,0 | 3,2 | 2,9 | 3,0 | 3,0 |
| Min - Max | 2,5 – 3,3 | 2,4 – 4,7 | 2,2 – 3,4 | 2,3 – 3,7 | 2,2 – 3,8 |
| D.E. | 0,3 | 0,4 | 0,3 | 0,3 | 0,4 |
En base a los síntomas observados en las muestras provenientes de campo y los producidos en las pruebas de patogenicidad, además de las características de las colonias, de los conidios desarrollados in vivo e in vitro, se concluye que las manchas foliares observadas en los híbridos de sorgo fueron ocasionadas por el hongo B. cookei. La enfermedad es considerada como de alto potencial de daño en las regiones cálidas y húmedas de países productores como India (Katewa et al., 2006) y Brasil (Silva et al., 2006). En Argentina, Acciaresi y Mónaco (1999) hallaron a B. cookei afectando sorgo de Alepo con una severidad de hasta 80 %. Al respecto, estos autores consideraron su potencial efecto como micoherbicida sobre dicha maleza al igual que investigadores extranjeros (Echemendía, 2005; Petrović et al., 1998). Giorda (2002) citó el patógeno en cultivos de sorgo y clasificó la enfermedad como “raramente observada” para la región sorguera argentina. Sin embargo, en los últimos años, en cultivos ubicados en la región noreste (norte de Santa Fe, Chaco y Corrientes), se han registrado ataques por lo cual actualmente se considera una enfermedad emergente (Espíndola et al., 2017) y potencialmente severa, pudiendo alcanzar niveles epidémicos (Cúndom et al., 2013). Hasta el presente, no se tiene conocimiento sobre su presencia en cultivos comerciales de sorgo de Entre Ríos.
En 1949, Lefebvre y Sherwin describieron a Helminthosporium sorghicola sobre S. sudanense. En 1959, Shoemaker crea el género Bipolaris y lo denomina B. cookei. Sucesivas reevaluaciones de su clasificación taxonómica la nombraron como Drechslera sorghicola y B. sorghicola. Actualmente, su denominación correcta es B. cookei (Index Fungorum, 2022; Manamgoda et al., 2014).
El rango de hospedantes de B. cookei comprende especies de la familia botánica Poaceae, principalmente del género Sorghum, entre ellos sorgo común y sorgo de Alepo; además, maíz (Zea mays), arroz (Oryza sativa), grama rhodes (Chloris gayana) y Eriochloa procera (Farr y Rossman, 2022). Por otro lado, el hongo ha sido aislado de Eucalyptus pauciflora, Foeniculum sp. y Musa sp. (Sivanesan, 1987). B. cookei, mediante inoculaciones artificiales, fue capaz de infectar células epidérmicas foliares de cebada (Hordeum vulgare), cebolla (Allium cepa) y Arabidopsis thaliana (Peng et al., 2016).
Al igual que otras enfermedades (Giorda, 1997), el posible impacto negativo de la “mancha por Bipolaris” o “mancha difusa” sobre la producción de sorgo dependerá tanto de la severidad como de la incidencia, las que a su vez estarán condicionadas principalmente por la cantidad de inóculo presente, la susceptibilidad de los híbridos, las prácticas culturales, las condiciones climáticas prevalecientes, así como también de la interacción de estos factores.
Si bien la identificación del organismo causal de la enfermedad se logró mediante el estudio de sus características morfométricas y culturales, es necesario complementar con técnicas moleculares a los fines de corroborar su identidad.
Conclusiones
Los síntomas observados en las muestras provenientes de campo y los producidos en las pruebas de patogenicidad, las características de las colonias, así como las de los conidios desarrollados in vivo e in vitro confirmaron a B. cookei como el organismo causal de las manchas foliares halladas en sorgo.
El conocimiento de la “mancha por Bipolaris” o “mancha difusa” del sorgo en la provincia de Entre Ríos y la caracterización de su agente etiológico constituyen un aporte relevante para el diagnóstico preciso de la enfermedad, aspecto básico y fundamental para su manejo.
Agradecimientos
A la Ing. Agr. (Dra.) Norma Formento de la EEA Paraná del INTA por la lectura crítica del manuscrito.
Referencias bibliográficas
Acciaresi, H., Mónaco, C. (1999). First report of Bipolaris sorghicola on Johnsongrass in Argentina. Plant Disease, 83, 965. doi.org/10.1094/PDIS.1999.83.10.965C
Ahmed, K.M., Ravinder Reddy, CH. (1993). A pictoral guide to the identification of seedborne fungi of sorghum, pearl millet, finger millet, chickpea, pigeonpea, and groundnut. International Crops Research Institute for the Semi-Arid Tropics, Patancheru, Andhra Pradesh, India. Information Bulletin N° 34. 200 p. http://oar.icrisat.org/5236/
Bolsa de Cereales de Buenos Aires (2022). Panorama Agrícola Semanal. 18 de agosto de 2022. https://www.bolsadecereales.com/download/pass/documento1/939
Cúndom, M.A., Cabrera, M.G. & Gutiérrez, S.A. (2013). Bipolaris sorghicola un patógeno emergente en cultivos de sorgo del NE de Argentina. Summa Phytopathologica, 39(4), 295-296. doi.org/10.1590/S0100-54052013000400014
Da Silva Ferreira, A., Casela, C.R. & De Almeida Pinto, N.F.J. (2007). Manejo de doenças na cultura do sorgo. Embrapa Milho e Sorgo. Circular Técnica 89. 20 p. https://www.embrapa.br/busca-de-publicacoes/-/publicacao/486484/manejo-de-doencas-na-cultura-do-sorgo
Di Rienzo, J.A., Casanoves, F., Balzarini, M.G., González, L., Tablada, M. & Robledo, C.W. (2020). InfoStat versión 2020. Centro de Transferencia InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. https://www.infostat.com.ar/
Echemendía, M. (2005). Registro de enfermedades fungosas en Sorghum halepense (L.) Pers. Revista de Protección Vegetal, 20(1), 32-38.
Espíndola, C.M., Wuthrich, A.F., Deambrosi, A.M. & Giorda, L.M. (2017). INTA AER Las Toscas y el sorgo. Investigación en campo de productor. Generación de conocimientos para producción ganadera. 15 p. https://inta.gob.ar/sites/default/files/inta_aer_las_toscas_y_el_sorgo-_web.pdf
Farr, D.F. & Rossman, A.Y. (2022). Fungal Databases, U.S. National Fungus Collections, ARS, USDA. https://nt.ars-grin.gov/fungaldatabases/
French, E.R. & Hebert, T.T. (1980). Métodos de investigación fitopatológica. IICA, San José, Costa Rica, 289 p.
Giorda, L.M. (1997). Enfermedades. En: Giorda, L.M. (Ed.). Sorgo granífero. INTA Centro Regional Córdoba, EEA Manfredi, Córdoba, pp. 40-46.
Giorda, L.M. (2002). Sorghum Diseases in Argentina. In: Leslie, J.F. (Ed.). Sorghum and Millet Diseases. Iowa State Press, Ames, Iowa, pp. 389-392.
Index Fungorum (2022). Bipolaris cookei (Sacc.) Shoemaker. http://www.indexfungorum.org/names/NamesRecord.asp?RecordID=293675
Katewa, R., Mathur, K. & Bunker, R.N. (2006). Assessment of losses in Sorghum due to target leaf spot (Bipolaris sorghicola) at varying disease severity levels. Indian Phytopathology, 59(2), 237-239. http://eprints.icrisat.ac.in/5267/
Manamgoda, D.S., Rossman, A.Y., Castlebury, L.A., Crous, P.W., Madrid, H., Chukeatirote, E. & Hyde, K.D. (2014). The genus Bipolaris. Studies in Mycology, 79(1), 221-288. doi.org/10.1016/j.simyco.2014.10.002
MICAM (2000). Microscope Image Capture and Measurement. Version 3.0.2. http://science4all.nl/?Microscopy_and_Photography
Peng, C., Ge, T.T., He, X.L., Huang, Y.H., Zu, Z.L., Zhang, D.Y., Shao, H.B. & Guo, S.W. (2016). Process of Bipolaris sorghicola invasion of host cells. Genetics and Molecular Research, 15(1), gmr.15016781. https://doi.org/10.4238/gmr.15016781
Petrović, T., Arsenijević, M. & Lević, J. (1998). The occurrence of Bipolaris sorghicola on Johnsongrass in Yugoslavia. Zaštita bilja, 49(1), 57-70. https://www.researchgate.net/publication/318199777_Occurrence_of_Bipolaris_sorghicola_on_Johnsongrass_in_Yugoslavia
Piontelli Laforet, E. (2015). Especies oportunistas de importancia clínica de los géneros Bipolaris Shoemaker y Curvularia Boedijn: su caracterización bajo los nuevos criterios taxonómicos. Boletín Micológico, 30(2), 40-63. doi.org/10.22370/bolmicol.2015.30.2.348
SIBER (2021). Informe Producción de Sorgo - Campaña 2021/22. Bolsa de Cereales de Entre Ríos. https://www.bolsacer.org.ar/Fuentes/siberd.php?Id=1396
Silva, D.D., Casela, C.R., Ferreira, A.S., Silva, V.A., Martins, Z.C., Borges, M.H.D., Castro, H.A. & Guimarães, F.B. (2006). Primeiro relato de Bipolaris sorghicola, agente etiológico da “mancha alvo” em sorgo, no Brasil. In: Congresso Nacional de Milho e Sorgo, 26: trabalhos apresentados. Sete Lagoas, MG, Brasil. https://www.alice.cnptia.embrapa.br/alice/handle/doc/490155
SINAVIMO (2022). Sistema Nacional de Vigilancia y Monitoreo de Plagas. https://www.sinavimo.gob.ar/
Sivanesan, A. (1987). Graminicolous species of Bipolaris, Curvularia, Drechslera, Exserohilum and their teleomorphs. Mycological Papers, 158, 1-261.
Tarr, S.A.J. (1962). Target leaf spot. Foliage Diseases 1. Diseases of Sorghum, Sudan Grass and Broom Corn. CAB. Kew, Surrey, pp. 118-119.
Vanderlip, R.L. (1993). How a Sorghum Plant Develops, Kansas State University, Agricultural Experiment Station and Cooperative Extension Service. https://bookstore.ksre.ksu.edu/pubs/s3.pdf
Yi, J.-H., Kim, J.-W. & Lee, D.-H. (2001). Identification of Bipolaris, Drechslera, and Exserohilum isolated from gramineous hosts in Korea. The Korean Journal of Mycology, 29(2), 100-115. https://www.koreascience.or.kr/article/JAKO200104637436478.do
Información adicional
Agradecimientos: A la Ing. Agr. (Dra.) Norma Formento
de la EEA Paraná del INTA por la lectura crítica del manuscrito.

