Dossier: especial suelos
Potencial de mineralización de nitrógeno en suelos con aplicación de cáscara de semilla de girasol
Potential nitrogen mineralization in soils with sunflower seed husk application
Revista FAVE Sección Ciencias Agrarias
Universidad Nacional del Litoral, Argentina
ISSN: 2346-9129
ISSN-e: 2346-9129
Periodicidad: Semestral
vol. 22, e0003, 2023
Recepción: 10 Junio 2022
Aprobación: 10 Noviembre 2022

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.
Resumen: El objetivo de este estudio fue evaluar el potencial de mineralización de nitrógeno (N) de suelos contrastantes luego del aporte de diferentes dosis de cascaras de semillas de girasol (CG) (Helianthus annuus L.), residuo abundante del sudoeste bonaerense (SOB). Se realizaron incubaciones aeróbicas de largo plazo (37 semanas), utilizando tres suelos diferentes (0-20 cm) y distintas dosis de CG calculadas con base en su contenido de N orgánico: 100 (D1), 200 (D2) y 400 (D3) kg N ha-1. Los suelos contrastaron en el contenido de fracciones granulométricas (S1: arena 509 g kg-1; limo 320 g kg-1 y arcilla 171 g kg-1; S2: arena 351 g kg-1; limo 448 g kg-1 y arcilla 201 g kg-1; S3: arena 827 g kg-1, limo 107 g kg-1 y arcilla 66 g kg-1). Las características químicas de CG: conductividad eléctrica= 1,6 dS m-1; pH= 5,6; materia orgánica (MO) = 958 g kg-1; N total= 7,8 g kg-1, relación C:N= 79. Los suelos demostraron diferencias significativas en el N potencialmente mineralizable (N0) con valores que fueron S1>S2>S3, al igual que en la tasa de mineralización (k) (S1 y S3= 0,0036 semana-1, S2=0,0056 semana-1). Se halló una interacción significativa en los aportes de CG y suelos, por lo que se analizó la incorporación en cada suelo. Cuando se aplicó CG, se observó una respuesta positiva sobre S3 con D1 y D2. Para S1 y S2, la aplicación de CG no aumentó el N0, aunque tampoco produjo un detrimento. La dinámica de la mineralización de N acumulada demostró efectos diferentes al aporte de CG con respecto al tipo de suelo. El aporte de CG al suelo incrementó el potencial de mineralización de N en el suelo arenoso-franco, sin disminuir el potencial en los suelos restantes, por lo que podría ser utilizada como enmienda orgánica bajo estas condiciones.
Palabras clave: N potencialmente mineralizable, residuo agroindustrial, sudoeste bonaerense, relación C:N, semiárido.
Abstract: The objective of this study was to evaluate the potential nitrogen (N) mineralization of contrasting soils after the addition of different sunflower seed hulls (CG) (Helianthus annuus L.) doses, an abundant residue of the southwest of Buenos Aires Province (SOB). Long-term aerobic incubations (37 weeks) were performed, using three different soils (0-20 cm) and various CG levels based on their organic N content: 100 (D1), 200 (D2) and 400 (D3) kg N ha-1. Soils differs in granulometric fractions (S1: sand 509 g kg-1; silt 320 g kg-1 and clay 171 g kg-1; S2: sand 351 g kg-1; silt 448 g kg-1 and clay 201 g kg-1; S3: sand 827 g kg-1, silt 107 g kg-1 and clay 66 g kg-1). The CG chemical characteristics: electrical conductivity= 1.6 dS m-1; pH= 5.6; organic matter (MO) = 958 g kg-1; total N= 7.8 g kg-1, C:N ratio = 79. Significant differences were found in potentially mineralizable N (N0) for three soils, whose values were S1>S2>S3; as well as in the mineralization rate (k) (S1 and S3= 0.0036 week-1, S2=0.0056 week-1). Significant interaction was found with the CG contribution and soils, so the contribution was analyzed for each soil. When GC was applied, a positive response was observed on S3 with D1 and D2. For S1 and S2, the application of GC did not increase the potential for N mineralization, however, it had not a detrimental effect on the potential. Dynamics of accumulated N mineralization showed different effects of CG addition with respect to soil type. The CG addition to soil increased the potential N mineralization in the sandy-loam soil, without reducing the potential in the remaining soils, which is why it could be used as an organic amendment under these conditions.
Keywords: potentially mineralizable N, agroindustrial residue, southwest of Buenos Aires Province, C:N ratio.
Introducción
La intensificación de la agricultura producida en los últimos años ha ocasionado una disminución del nivel de MO de los suelos (Duval et al., 2020). En el sudoeste bonaerense (SOB) los sistemas agropecuarios fueron tradicionalmente mixtos con un adecuado balance de agricultura y ganadería y alternancia de cultivos anuales y praderas, aproximándose a la vocación natural de estos suelos (Viglizzo et al., 2011). En las últimas décadas, se fue abandonando la rotación agronómica, con una visible tendencia hacia la agriculturización (Moisés et al., 2022), lo que implicó una mayor degradación del recurso suelo. Las consecuencias medioambientales y económicas del deterioro del recurso de base obligan a un serio replanteo de las asignaciones de uso y a la adopción de tecnologías y prácticas de manejo tendientes a minimizar y/o revertir los procesos desencadenados por la aplicación de prácticas inadecuadas. Este efecto degradativo podría revertirse mediante la correcta reutilización de residuos agropecuarios dentro de los agrosistemas (Tian et al., 2009, Masunga et al., 2016).
Dentro del SOB, se genera una gran cantidad de residuos provenientes de diferentes actividades agroindustriales de difícil degradación que producen problemas ambientales y sanitarios. Entre ellos, los más abundantes corresponden a la industria aceitera. La cáscara de semilla de girasol (CG), de difícil degradación por su alto contenido de lignina, posee una producción de 54 mil toneladas anuales (Moisés et al., 2018). Es un residuo que posee una gran cantidad de carbono orgánico (CO) en su composición lo que resulta en una elevada relación C:N (Curvetto et al., 2005). Según Lal (2004), el uso y aplicación de residuos con alto contenido de lignina incrementa el contenido de CO del suelo. Sin embargo, la elevada C:N podría afectar la dinámica del N disponible para las plantas (Iglesias Jiménez et al., 2008). Es importante remarcar que la fertilización es inferior a las necesidades de los cultivos en esta región, por lo que la reutilización de residuos podría ser una alternativa que permita mantener o aumentar fertilidad edáfica. Con el agregado de material orgánico al suelo se puede generar cambios en el ciclado de la materia orgánica (MO) del suelo (Blagodatsky et al., 2010), la cual tiene una importante participación en la dinámica del N (Martínez et al., 2017a) y está ligada a la productividad por que influye en la disponibilidad de nutrientes para los cultivos (Galantini & Suñer, 2008). Sin embargo, no se conoce con exactitud la capacidad de liberación de N por parte de los residuos agroindustriales cuando son aplicados al suelo y se descomponen, especialmente en ambientes semiáridos. La aplicación de materiales orgánicos influye directamente sobre la calidad del suelo y el desarrollo vegetal, tanto en forma directa por acción per se de los nutrientes contenidos, como en forma indirecta mejorando las propiedades físicas, químicas y biológicas del suelo (Abassi & Khizar, 2012). En general, la mayor parte del contenido de N de los residuos se encuentra en forma orgánica (Thomas et al., 2015), por lo cual debe mineralizarse a formas inorgánicas para evaluar su condición como potencial enmienda orgánica. La aplicación de residuos orgánicos contribuye de esta manera a reducir las pérdidas de N, debido a que favorecen una mayor sincronización con las necesidades de los cultivos (Myers et al., 1994), pudiendo tener un efecto residual de la fertilidad nitrogenada (Wen et al., 2003). Sin embargo, la magnitud del efecto residual depende de la interacción entre el tipo de residuo (calidad) y las características del suelo (Webb et al., 2013). Los procesos de mineralización-inmovilización del material orgánico agregado al suelo contribuyen fuertemente a la disponibilidad de N para el cultivo y su posterior crecimiento (Abassi & Khizar, 2012). Es necesario mejorar la comprensión de los procesos involucrados en la transformación de N, luego de la aplicación de residuos con el fin de lograr una mejor sincronía entre la liberación de nutrientes y la absorción por parte de las plantas. Además, la cantidad de N potencialmente mineralizada a partir de materiales orgánicos es una variable importante a considerar al recomendar la tasa adecuada para satisfacer las necesidades de N para una producción óptima de cultivos sin riesgos para el ambiente (Abbasi et al., 2007).
La mayoría de las estimaciones de la contribución N proveniente de la mineralización del suelo se basan en incubaciones aeróbicas de largo plazo (Stanford & Smith, 1972), que determinan la fracción de N del suelo que se puede convertir en formas minerales (N potencialmente mineralizable, N0). La hipótesis planteada es que la aplicación de CG al suelo en diferentes dosis incrementa el potencial de mineralización de N por el aporte que realiza de CO. El objetivo fue evaluar el potencial de mineralización de N del suelo luego del agregado de CG en diferentes dosis para suelos contrastantes del SOB, para conocer su potencialidad como enmienda orgánica.
Materiales y Métodos
Se realizaron incubaciones de largo plazo durante 37 semanas consecutivas combinando suelos contrastantes y CG con diferentes niveles de dosificación. Se utilizó un diseño experimental completamente aleatorizado con cuatro replicas. Para esto, se tomaron muestras superficiales de tres suelos característicos de la región del SOB (profundidad de 0-20 cm) de un establecimiento localizado en Las Oscuras, Provincia de Buenos Aires (Figura 1). Los suelos muestreados pertenecen al orden Molisoles (Soil Survey Staff, 2010), caracterizados por bajos contenidos de CO, texturas gruesas y aportes variables de MO particulada por los residuos de los cultivos (Martínez et al., 2016). La muestra compuesta de cada suelo se secó al aire, se homogenizó y se tamizó (malla de 2 mm). Se determinaron las siguientes propiedades edáficas: carbono orgánico (CO) que se estimó a partir de la determinación de MO por el método de calcinación, utilizando un factor de conversión de 2,2 (Martínez et al., 2017b), P extraíble (Pe) (Bray & Kurtz, 1945); y pH en suspensión suelo: agua 1:2,5. Además, se determinaron las diferentes fracciones granulométricas por el método de la pipeta de Robinson y se clasificó la textura. Los datos analíticos de los suelos se detallan en la Tabla 1.
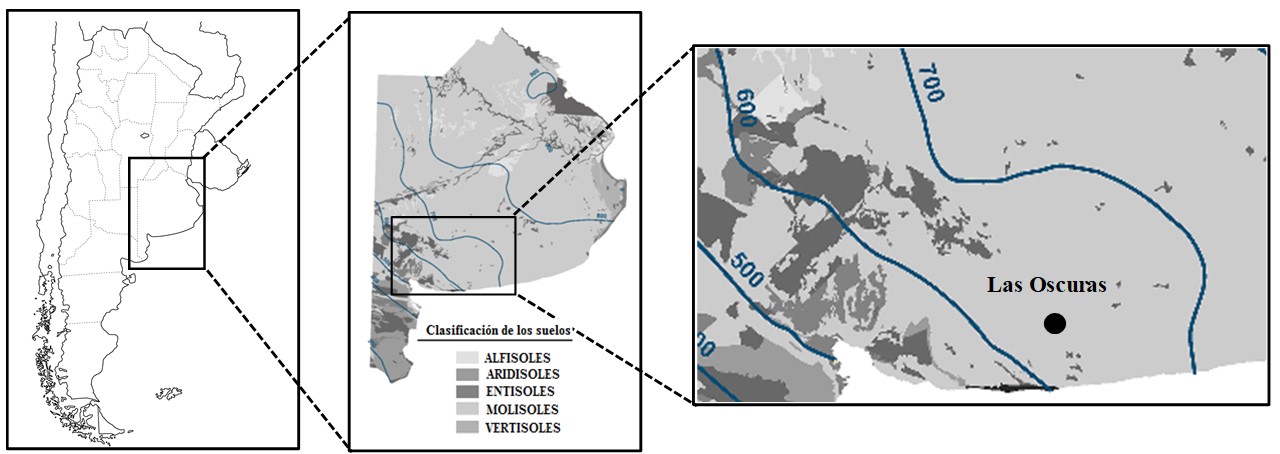
Figura 1 / Figure 1
Locación del sitio donde se tomaron las muestras de suelo (0-20 cm) para llevar a cabo las incubaciones de largo plazo. / Site location of sampled soil (0-20 cm) for long-term incubation.
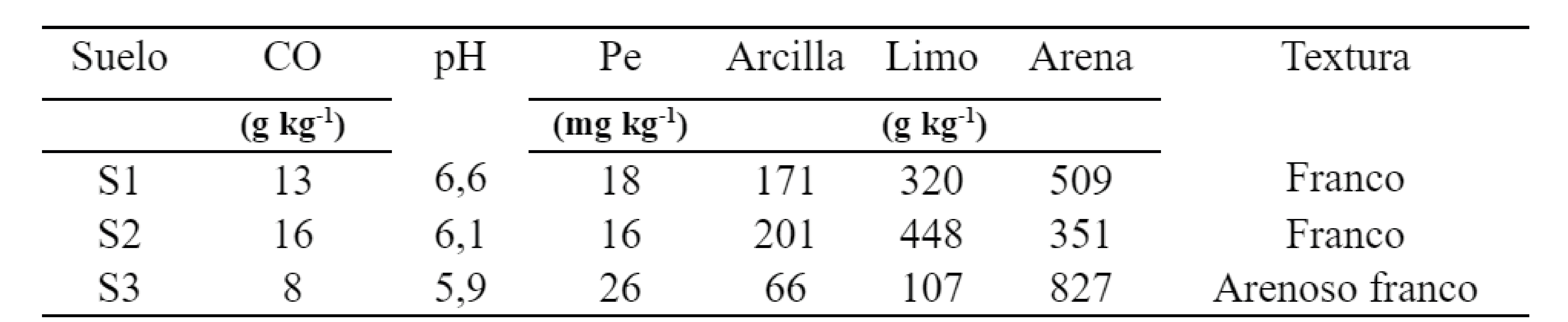
CO: carbono orgánico total; Pe: fósforo extraíble.
Caracterización química de la cascara de girasol
Para su caracterización química y posterior aplicación, la CG se dispuso a secar en estufa a 60°C por 48 horas y se molió con malla de 1 mm de diámetro. Se realizaron las siguientes determinaciones para el análisis químico: MO a través del método calcinación en mufla a 550° por 4 h (Martínez et al., 2017b), carbono orgánico (CO) por analizador automático Leco Truspec (Leco Corporation, St Joseph, MI), N total (Nt) mediante el método semi-micro Kjeldahl (Bremner, 1996), fósforo total (Pt) (Sommers & Nelson, 1972), pH y conductividad eléctrica (CE) por método 1+5 v/v (Bárbaro, 2011). Las determinaciones de Potasio (K), Azufre (S), Magnesio (Mg), Cobre (Cu) y Zinc (Zn) se llevaron a cabo por espectrometría de absorción atómica (Kabata-Pendias & Pendias, 2001).
Incubación aeróbica de largo plazo
Se realizó una incubación aeróbica de largo plazo siguiendo el protocolo de Honeycutt et al. (2005). El procedimiento consistió en pesar 400 g de masa de suelo seco al aire, que fueron colocados en frascos de vidrio de 1 L. A cada frasco se le agregó CG en cantidades equivalentes a 0 (suelo sin aplicación), 100 (D1), 200 (D2) y 400 (D3) kg N ha-1, con base en su composición de N orgánico. Los niveles aportados de CG se calcularon siguiendo el protocolo de Honeycutt et al. (2005), en base a la cantidad de suelo inicial utilizado. Inicialmente, se estimó la porosidad total (PT) de los suelos muestreados secos al aire y por porcentaje en masa de suelo se determinó el 60% de PT, siendo un valor aproximado a la capacidad de campo (CC). Se ajustó la humedad (H°) gravimétrica actual de los suelos en los frascos a 60% de la PT y se incubó durante cinco ciclos de humedecimiento y secado con una temperatura de 25°C. Diariamente, se realizaba el pesaje de las muestras hasta el momento en que la humedad actual llegaba al 30% de la PT, estimada por diferencias de masa. Luego se rehidrataban las muestras distribuyendo el riego en forma homogénea hasta el 60% calculado por masa de suelo, se dejaba estabilizar unas horas y luego se procedía a muestrear con un sacabocados para la determinación de N inorgánico (N-NO3-+N-NH4+) mediante destilación por arrastre de vapor (Mulvaney, 1996). Luego de transcurridos los cinco ciclos de humedecimiento y secado (t), se determinó el N0 y k con un software informático asumiendo que el N mineralizado acumulado (Nmin) se comportaba en forma exponencial de primer orden (Stanford & Smith, 1972). La duración aproximada de la incubación superó ampliamente la propuesta por Wang et al. (2003), quienes concluyeron que esta debía de ser de por lo menos de 24 semanas para obtener datos fiables en ensayos para evaluar el potencial de mineralización. Para el cálculo del N inorgánico acumulado no se tuvo en cuenta el N inorgánico obtenido, luego del rehidratado inicial a los 10 días.
Análisis estadístico
Luego de finalizada el periodo de incubación que constó de cinco t, se determinó el N potencialmente mineralizable (N0) (mg kg-1) y la tasa de mineralización (k) (semana-1), utilizando regresiones no lineales por el método iterativo a través del modelo (Ecuación 1) propuesto por Stanford & Smith (1972):
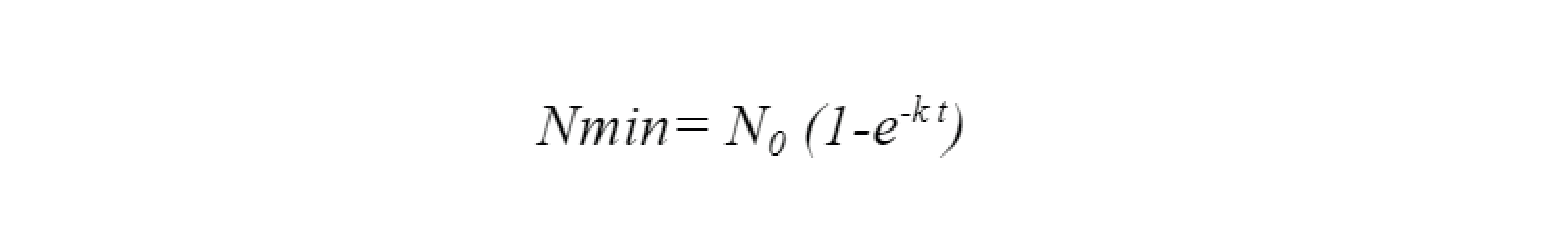 [Ecuación
1]
[Ecuación
1]Nmin es el N mineralizado acumulado en el tiempo t, N0 es el N potencialmente mineralizable, k es la tasa constante de mineralización y t son ciclos de humedecimiento y secado.
Inicialmente, se realizó el análisis de la varianza (ANAVA) comparando el N0 y k para los suelos contrastantes. Luego, se realizó el ANAVA doble comparando el efecto de los suelos (factor principal) y aportes de CG (factor secundario) sobre el N0 y k. La comparación de medias se realizó por el método de diferencias mínimas significativas de Fisher (p<0,05). Los análisis estadísticos se realizaron utilizando el software informático Infostat (Di Rienzo et al., 2018).
Resultados y discusión
Caracterización química de CG
En la Tabla 2 se detallan los resultados del análisis químico de CG. Los criterios estandarizados utilizados por la Unión Europea (UE) (Decisión 2001/688/EC), estipulan que este residuo posee mayormente los requisitos para que su aplicación no afecte la salud humana y ambiental. Entre ellos, la CE es de los parámetros más importantes, presentando un valor inferior a 2,5 dS m-1, nivel considerado tolerable por plantas de sensibilidad media (Lasaridi et al., 2006). Por su parte, los valores de pH fueron levemente ácidos, hallándose por debajo del rango de 6,0-8,5 recomendado para el crecimiento de las plantas (Hogg et al., 2002). Los contenidos de CO se hallan por encima de los 200 g CO kg-1 propuesto por la UE. Por su parte, el Nt presentó un valor cercano al rango de referencia (10-20 g kg-1) sugerido por Alexander (1994). Los nutrientes K, Mg y S presentaron valores elevados en su composición. Entre los metales pesados, Cu y Zn presentaron valores muy inferiores a los limites considerados perjudiciales para el ambiente (USEPA, 1993). La relación C:N, relacionada con la tasa de descomposición de los residuos orgánicos (Heal et al., 1997) presentó valores elevados posiblemente atribuido por la cantidad de lignina que posee este residuo según Curvetto et al. (2005).

Potencial de mineralización de los suelos
Los suelos demostraron diferencias significativas (p=0,0015) en el N0, con valores que siguieron el orden S1>S2>S3 (Figura 2). Además, se hallaron diferencias significativas (p=0,01) en la tasa de mineralización (k) entre S1 y S3 con S2, con mayor k para el último. Para S1 y S3, la tasa k promedio arrojó un valor de 0,0036 semana-1, mientras que para S2, el k fue de 0,0056 semana-1, situándose en cercanía al valor propuesto por Stanford & Smith (1972) de 0,0054 semana-1. Otros autores (Ros et al., 2011; Martínez et al.,2017a; 2018) han hallado una relación estrecha del N0 con las fracciones orgánicas. Sin embargo, en este estudio no se observa una relación lineal entre el N0 y el COT de los suelos (Tabla 1). Según Martínez et al. (2018), las diferencias en las fracciones granulométricas de los suelos podrían desencadenar variabilidad en la tasa de mineralización, siendo superior en suelos con mayor contenido de arenas por la menor protección física de la MO por parte de las arcillas. Sin embargo, en este estudio se halló la mayor tasa en S2, el cual tiene el mayor contenido de arcilla, posiblemente atribuido a las escasas diferencias en la clase textural de los suelos utilizados.
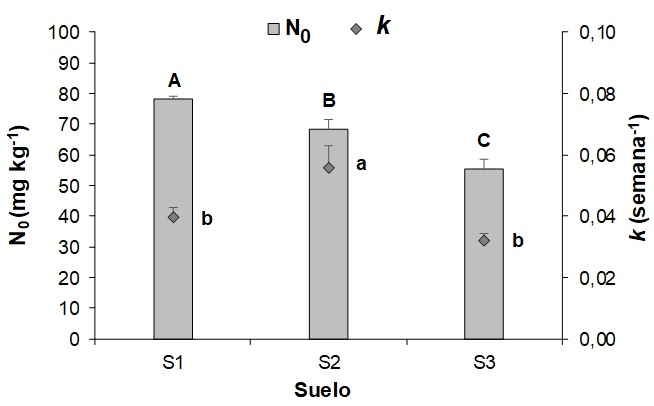
Figura 2 / Figure 2
Nitrógeno potencialmente mineralizable (N0) y tasa de mineralización (k) para cada suelo -sin agregado de CG- al final de la incubación. Letras diferentes mayúsculas y minúsculas indican diferencias significativas (p<0,05) entre suelos para N0 y k, respectivamente. Barras verticales indican el desvío estándar. / Potentially mineralizable nitrogen (N0) and constant rate (k) for each soil -without CG application- at the end of long-term incubation. Different uppercase and lowercase letters indicate significant differences (p<0.05) for N0 and k for soils, respectively. Vertical bars indicate standard deviation.
Potencial de mineralización de los suelos con aplicación de CG
El ANOVA doble demostró una interacción significativa (p<0,0001) entre los suelos y aportes de CG con respecto al N0 y k, por lo que se procedió a analizar los niveles de CG para cada suelo. Cuando se evaluó el aporte de diferentes niveles de CG a los suelos (Figura 3a) para N0, se observó una respuesta positiva sobre S3 con D1 y D2. Contrariamente, para S1 y S2, la aplicación de CG no aumentó el N0, pero tampoco lo disminuyó con respecto al suelo sin aplicación de CG. Considerando que CG es un residuo con elevada relación C:N (Curvetto et al., 2005), los resultados no sugieren procesos de inmovilización de N ni siquiera en los primeros momentos de la incubación. Varios autores (Corbeels et al., 2000; DeNeve et al., 2004; Reddy et al., 2008) reportaron que la incorporación de residuos con elevada C:N favorece la inmovilización de N durante las etapas iniciales de descomposición, para luego de un tiempo de proceso, comenzar con la liberación de N inorgánico. Estos resultados permiten inferir que el aporte de CG podría incrementar el potencial de mineralización de N del suelo, mejorando la fertilidad. Sin embargo, no es una tendencia general en los suelos testeados. Para este estudio, el aumento evidente en el N0 se observó en el caso del suelo con textura gruesa (arenoso-franco) y con el menor nivel de COT, lo que podría estar ligado a la menor protección física por parte de las arcillas. Es importante destacar que, si bien en S1 y S2 no se observaron incrementos en el N0, el agregado del residuo con elevado CO en su composición, podría incrementar los niveles de MO del suelo, aumentando la calidad edáfica.
Lo que respecta al k, cuando se aplicaron diferentes dosis de CG para S1 y S3, no se observaron efectos positivos y negativos, excepto en S3+D1 donde se evidencia una reducción en la tasa (Figura 3b). En cambio, para S2 se observa que con el aumento de dosis se redujo significativamente la tasa.
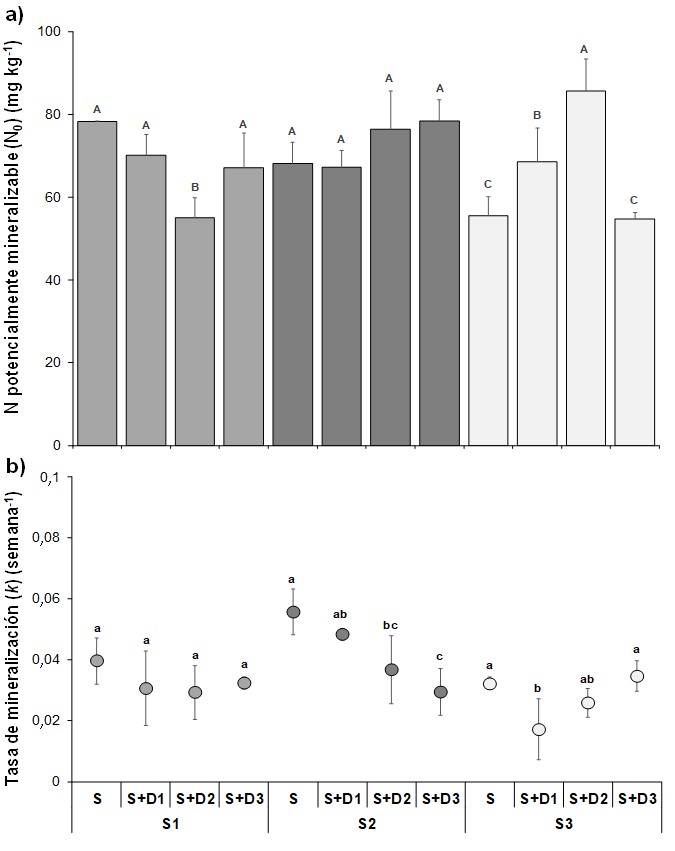
Figura 3 / Figure 3
Nitrógeno potencialmente mineralizable (N0) (a) y tasa de mineralización (k) (b) según suelo y con dosis de CG. Letras diferentes indican diferencias significativas de N0 y k para cada suelo. Barras verticales indican el desvío estándar. S, suelo sin aplicación de CG; S1-S2-S3+D1, D2 y D3; con aplicación de CG. / Potentially mineralizable nitrogen (N0) (a) and constant rate (k) (b) for soils without and with different CG rates application. Different letters indicate significant differences for N0 and k for each soil. Vertical bars indicate standard deviation. S, soil without CG application; S1-S2-S3+D1, D2 and D3; soil with CG application.
Dinámica de la mineralización de N
La dinámica de la mineralización de N acumulada demostró efectos diferentes al agregado de CG con respecto al tipo de suelo (Figura 4). En general, las dinámicas mostraron variaciones entre los tiempos de incubación, como ha sido reportado por Lazicki et al. (2020).
Para S1, las aplicaciones de CG durante el primer tiempo de incubado mostraron menores cantidades de N inorgánico liberado con respecto al suelo sin aplicación, revirtiéndose esta situación a partir de los siguientes tiempos de incubado (Figura 4a). Esto podría deberse por la gran demanda de N por parte de la biomasa microbiana cuando se incorpora un residuo con elevada C:N (Kirchmann & Lundvall). Además, la liberación de N inorgánico de este residuo no ocurriría durante los momentos iniciales, sino luego de un tiempo considerado de incubación como fue reportado por varios autores (DeNeve et al., 2004; Reddy et al., 2008). Según Zibilske et al. (2000) cuando se agregan residuos con elevada C:N al suelo como la CG, se necesita mayor cantidad de tiempo para evidenciar su efecto sobre las propiedades del suelo. El mayor pico de liberación de N inorgánico se produjo en el suelo sin aplicación luego de transcurridos 142 días de incubación (tercer ciclo de incubación). Para S2, estas diferencias entre el suelo y con aplicación de CG no se observan para los primeros tiempos de incubado (Figura 4b), a pesar de las características químicas de la CG. Esto podría deberse al mayor contenido de CO de este suelo (Tabla 1), lo que redunda en mayor sustrato energético disponible para la biomasa microbiana, sin generar un detrimento en la cantidad del N liberado. En cambio, S3 mostró una tendencia similar a S1 (Figura 4c), aunque presentó marcadas fluctuaciones en el N inorgánico liberado para cada ciclo de la incubación. Considerando que las regresiones no lineales para calcular el N0 podrían enmascarar los procesos de inmovilización, la evaluación de la dinámica del N inorgánico liberado a lo largo de la incubación permite detectar este proceso de transformación de N, que para las condiciones particulares de este estudio no se evidenciaron.
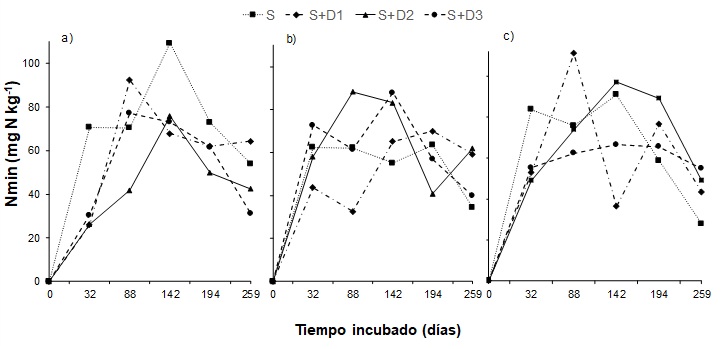
Figura 4 / Figure 4
Dinámica de mineralización de N acumulada (Nmin) para S1 (a), S2 (b) y S3 (c) con el agregado de CG en diferentes dosis. S1, suelo franco; S2, suelo franco fino; S3, arenoso-franco; S, suelo sin aplicación de CG; S1-S2-S3+D1, D2 y D3; con aplicación de CG. / Accumulated N mineralization dynamics for S1 (a), S2 (b) and S3 (c) with different doses of CG application. S1, loamy soil; S2, fine-loamy soil; S3, sandy-loam soil; S, soil without CG application; S1-S2-S3+D1, D2 and D3; soil with CG application.
Conclusiones
El agregado de CG al suelo incrementó el potencial de mineralización de N en el suelo de textura gruesa (arenoso-franco). Sin embargo, con la dosis más elevada se visualizó un detrimento. En los otros suelos logró mantener los valores sin aplicación y posiblemente haya incorporado CO al suelo. Para las condiciones particulares de este estudio, la CG aplicada al suelo en dosis niveladas con base al N orgánico de su composición, podría utilizarse como una enmienda orgánica, resolviendo de esta manera una problemática ambiental con su posterior eliminación.
La dinámica de la mineralización de N ante dosis incrementales de CG mostró una gran variabilidad independientemente del suelo considerado, sin inferir estar asociado a algún parámetro edáfico en particular. Es importante remarcar que es necesario, como trabajo a futuro, analizar las demás fracciones orgánicas de C y N del suelo, y como afecta su dinámica el aporte de este residuo agroindustrial.
Agradecimientos
Al proyecto de Unidades Ejecutoras CERZOS- Bioconversión y valorización de residuos agroindustriales del sudoeste bonaerense; y el Proyecto de Investigación Científica y Tecnológica “Uso de residuos agroindustriales biotransformados en sistemas productivos del sudoeste bonaerense: efectos sobre la calidad edáfica y ambiental” (PICT 2017-1962).
Referencias bibliográficas
Abbasi, M.K., & Khizar, A. 2012. Microbial biomass carbon and nitrogen transformations in a loam soil amended with organic–inorganic N sources and their effect on growth and N-uptake in maize. Ecological Engineering, 39, 123-132.
Abbasi, M.K., Hina, M., Khalique, A., & Razaq Khan, S. (2007). Mineralization of three organic manures used as nitrogen source in a soil incubated under laboratory conditions. Communications in Soil Science and Plant Analysis, 38(13-14), 1691-1711.
Alexander, R.A. (1994). Standards and guidelines for compost use. Biocycle, 35(12), 37-41.
Barbaro, L.A., Karlanian, M.A., Imhoff, S., Morisigue, D.E. (2011). Caracterización de la turba subtropical del departamento Islas de Ibicuy (Entre Ríos, Argentina). Agriscientia, 28(2), 137-145.
Blagodatsky, S., Blagodatskaya, E., Yuyukina, T., Kuzyakov, Y. (2010). Model of apparent and real priming effects: linking microbial activity with soil organic matter decomposition. Soil Biology and Biochemistry, 42, 1275-1283.
Bremner, J.M. (1996). Nitrogen - Total. In: D.L. Sparks (Ed.), Methods of soil analysis. Part 3. Chemical Methods (pp. 1085-1121). ASA, SSSA, CSSA, Madison WI.
Bray, R.H., & Kurtz, L.T. (1945). Determination of total, organic and available forms of phosphate in soils. Soil Science, 59, 39-45.
Corbeels, M., Hofman, G., Cleemput, O.V. (2000). Nitrogen cycling associated with the decomposition of sunflower stalks and wheat straw in a Vertisol. Plant Soil, 218, 71–82.doi:10.1023/A:1014904505716.
Curvetto, N.R., Figlas, D., Gonzales, M.R. & Delmastro, S. (2005). Mushroom Growers Handbook 2: Shiitake Cultivation (pp. 127-133). MushWorld, Seoul, Korea.
DeNeve, S., Gaona-Sàez, S., Daguilar, B.C., Sleutel, S., Hofman, G. (2004). Manipulating N mineralization from high N crop residues using on- and off-farm organic materials. Soil Biology and Biochemistry, 36, 127–134.doi: 10.1016/j.soilbio.2003.08.023.
Di Rienzo, J.A., Casanoves, F., Balzarini, M.G., Gonzalez, L., Tablada, M., Robledo, C.W. (2018). InfoStat, versión 2018. Grupo InfoStat, FCA. Universidad Nacional de Córdoba (Argentina).
Duval, M.E., Martinez, J.M., Galantini, J.A. (2020). Assessing soil quality indices based on soil organic carbon fractions in different long‐term wheat systems under semiarid conditions. Soil Use and Management, 36(1), 71-82.
Galantini, J.A., & Suñer, L. (2008). Soil organic matter fractions: analysis of Argentine soils. Agriscientia, XXV (1), 41-55.
Heal, O.W., Anderson, J.M., Swift, M.J. (1997). Plant Litter Quality and Decomposition: An Historical Overview. In: G. Cadish & K.E. Killer (Eds.). Driven by Nature: Plant Litter Quality and Decomposition. (pp. 3-30).
Hogg, D., Favoino, E., Centemero, M., Caimi, V., Amlinger, F., Devliegher, W., Brinton, W., Antler, S. (2002). Comparison of compost standards within the EU, North America and Australia, The Waste and Resources Action Programme (WRAP), Oxon.
Honeycutt, C.W., Griffin, T.S., Weinhold, B.J., Eghball, B., Albrecht, S.L., Powell, J.M., Woodbury, B.L., Sistani, K.R., Hubbard, R.K., Torbert, H.A., Eigenberg, R.A., Wright, R.J., Jawson, M.D. (2005). Protocols form nationally coordinated laboratory and field research on manure nitrogen mineralization. Communications in Soil Science and Plant Analysis, 36, 2807-2822.
Iglesias-Jiménez, E., Barral, M.T., Marhuenda, F.C. (2008). Indicadores de la estabilidad y madurez del compost. En: J. Moreno & R. Moral (Eds). Compostaje. (pp. 243-283). Ediciones Mundi-Prensa, Madrid.
Kabata-Pendias, A., & Pendias, H. (2001). Trace Elements in Soils and Plants. CRC Press, Boca Raton, EEUU.
Kirchmann, H., & Lundvall, A. (1993) Relationship between nitrogen immobilization and volatile fatty acids in soil after application of pig and cattle slurry. Biology and Fertility of Soils, 15, 161–164.
Lal, R. (2004). Carbon sequestration in dryland ecosystems. Environmental Management, 33, 528-544.
Lasaridi, K., Protopapa, I., Kotsou, M., Pilidis, G., Manios, T., Kyriacou, A. (2006). Quality assessment of composts in the Greek market: the need for standards and quality assurance. Journal of Environmental Management, 80(1), 58-65.
Lazicki, P., Geisseler, D., Lloyd, M. (2020). Nitrogen mineralization from organic amendments is variable but predictable. Journal of Environmental Quality, 49, 483-495.
Martínez, J.M., Galantini, J.A., Duval, M.E. (2018). Contribution of nitrogen mineralization indices, labile organic matter and soil properties in predicting nitrogen mineralization. Journal of Soil Science and Plant Nutrition, 18(1), 73-89.
Martínez, J.M., Galantini, J.A., Duval, M.E., López, F.M. (2017a). Tillage effects on labile pools of soil organic nitrogen and relationships with wheat crop in a semi-humid climate: A long-term field study. Soil and Tillage Research, 169, 71-80.
Martínez, J.M., Galantini, J.A., Duval, M.E. López, F.M., Iglesias, J.O. (2017b). Ajustes en la estimación de carbono orgánico por el método de calcinación en Molisoles del sudoeste bonaerense. Ciencia del Suelo, 35, 181-187.
Martínez, J.M., Galantini, J.A., Landriscini, M.R., López, F.M., Duval, M.E. (2016). Fertilización nitrogenada en trigo de la región subhúmeda: eficiencia del uso del agua y nitrógeno. Ciencia del Suelo 34, 81-92.
Masunga, R.H., Uzokwe, V.N., Mlay, P.D., Odeh, I., Singh, A., Buchan, D., De Neve, S. (2016). Nitrogen mineralization dynamics of different valuable organic amendments commonly used in agriculture. Applied Soil Ecology, 101, 185-193.
Moisés, J., Martínez, J.M., Duval, M.E., Iocoli, G., Galantini J.A. (2022). Cáscaras de girasol con diferentes transformaciones como enmiendas orgánicas en trigo. Ciencia del Suelo, en prensa.
Moisés, J., Martínez, J.M., Duval, M.E., Iglesias, J.O., Galantini J.A. (2018). Transformaciones de la cáscara de girasol y potencialidad de uso como enmiendas orgánicas. En Actas: XXVI Congreso Argentino de la Ciencia del Suelo, Tucumán, Argentina.
Mulvaney, R.L. (1996). Nitrogen-Inorganic forms. In: D.L. Sparks (Ed.), Methods of soil analysis. Part 3. Chemical Methods (pp. 1123-1184). ASA, SSSA, CSSA, Madison WI.
Myers, R.J.K., Palm, C.A., Cuevas. E., Gunatilleke, I.U.N., Brussaard, M. (1994). The synchronisation of nutrient mineralisation and plant nutrient demand. In: P.L. Woomer, & M.J. Swift (Eds). The biological management of tropical soil fertility. (pp. 81-116). Wiley, Chichester.
Reddy, K.C., Reddy, S.S., Malik, R.K., Lemunyon, J.L., Reeves, D.W. (2008). Effect off five-year continuous poultry litter use in cotton production on soil major nutrients. Agronomy Journal, 100, 1047–1055. doi:10.2134/agronj2007.0294.
Ros, G.H., Temminghoff, E.J.M., Hoffland, E. (2011). Nitrogen mineralization: a review and meta‐analysis of the predictive value of soil tests. European Journal of Soil Science 62(1), 162-173.
Sainz Rozas, H., Echeverria, H.E., Angelini, H. (2011). Niveles de carbono orgánico y pH en suelos agrícolas de la región pampeana y extrapampeana argentina. Ciencia del Suelo, 29, 29-37.
Soil Survey Staff. (2010). Keys to Soil Taxonomy, 11th ed. USDA-Natural Resources 22. Conservation Service, Washington, DC.
Sommers, L.E., & Nelson, D.D.W. (1972). Determination of total phosphorus in soil. Soil Science Society of American Proceeding, 36, 902-904.
Stanford, G., & Smith, S. (1972). Nitrogen mineralization potentials of soils. Soil Science Society of American Proceedings 36, 465-472.
Thomas, B.W., Sharifi, M., Whalen, J.K., Chantigny, M.H. (2015). Mineralizable nitrogen responds differently to manure type in contrasting soil textures. Soil Science Society of American Journal, 79, 1396-1405.
Tian, G., Granato, T.C., Cox, A.E., Pietz, R.I., Carlson C.R., Abedin, Z. (2009). Soil carbon sequestration resulting from long-term application of biosolids for land reclamation. Journal of Environmental Quality, 38, 61-74.
USEPA, 1993. Standards for the use or disposal of sewage sludge. Federal Register, 58 (32), 9248-9415.
Viglizzo, E.F., Frank, F.C., Carreño, L.V., Jobaggy, E.C., Pereyra, H., Clatt, J., Pincen, D., Ricard, M.F. (2011). Ecological and environmental footprint of 50 years of agricultural expansion in Argentina. Global Change Biology 17, 959–973.
Wang, W.J., Smith, C.J., Chen, D. (2003). Towards a standardised procedure for determining the potentially mineralisable nitrogen of soil. Biology and Fertility of Soils 37, 362-374.
Webb, J., Sørensen, P., Velthof, G., Amon, B., Pinto, M., Rodhe, L., Salomon, E., Hutchings, N., Burczyk, P., Reid, J. (2013). An assessment of the variation of manure nitrogen efficiency throughout Europe and an appraisal of means to increase manure-N efficiency. Advances in Agronomy 119, 371-441.
Wen, G., Inanaga, S., Schoenau, J.J., Charles, J.L. (2003). Efficiency parameters of nitrogen in hog and cattle manure in the second year following application. Journal of Plant Nutrition and Soil Science 166, 490-498.
Zibilske, L.M., Clapham, W.M., Rourke, R.V. (2000). Multiple applications of paper mill sludge in an agricultural system: Soil effects. Journal of Environmental Quality, 29, 1975-1981.


