



Comunicaciones
Microdochium sorghi en sorgo en el noroeste de Entre Ríos, Argentina
Microdochium sorghi on sorghum in northwestern Entre Ríos, Argentina
Revista FAVE Sección Ciencias Agrarias
Universidad Nacional del Litoral, Argentina
ISSN: 2346-9129
ISSN-e: 2346-9129
Periodicidad: Semestral
núm. 23, e0030, 2024
Recepción: 05 Marzo 2024
Aprobación: 04 Julio 2024

Resumen: A comienzos de diciembre de 2021, en un cultivo de sorgo situado en el departamento La Paz, Entre Ríos, Argentina, se observaron plantas con hojas que presentaban atizonamiento, abarcando todo el ancho de la lámina desde el ápice y hasta la mitad de la misma. En todos los casos, estas áreas incluían pequeñas manchas castaño-oscuras, algunas con el centro más claro, semicirculares a elípticas o alargadas y, en general, delimitadas por las nervaduras foliares. Las observaciones preliminares identificaron a un hongo productor de esporodoquios y microesclerocios. Los objetivos del trabajo fueron caracterizar biológicamente e identificar el organismo causal de la enfermedad. Las características morfológicas y culturales del hongo, así como la sintomatología observada en la prueba de patogenicidad, se correspondieron con las descripciones realizadas para Microdochium sorghi (= Gloeocercospora sorghi), causante de la “mancha zonada de la hoja” o “mancha concéntrica” del sorgo. La información obtenida contribuye al conocimiento de este patosistema y reafirma la importancia del diagnóstico correcto de enfermedades de este cultivo.
Palabras clave: Sorghum, enfermedad, mancha zonada, hongo.
Abstract: At the beginning of December 2021, in a sorghum crop located in the department of La Paz, Entre Ríos, Argentina, it was observed with leaves showing blight, which covered the entire width of the lamina from the apex to the middle of the lamina. In all cases, these areas included small dark brown spots, some with a lighter centre, semicircular to elliptical or elongated and, in general, delimited by the leaf veins. Preliminary observations identified a fungus producing sporodochia and microsclerotia. The objectives of the work were to biologically characterize and identify the causal organism of the disease. The morphological and cultural characteristics of the fungus, as well as the symptomatology observed in the pathogenicity test, corresponded to the descriptions made for Microdochium sorghi (= Gloeocercospora sorghi), the cause of the “zonate leaf spot” of sorghum. The information obtained contributes to the knowledge of this pathosystem and reaffirms the importance of the correct diagnosis of diseases of this crop.
Keywords: Sorghum, disease, zonate leaf spot, fungus.
Introducción
En Argentina, el cultivo del sorgo (Sorghum spp.) se presenta como un recurso clave en la ganadería gracias a su versatilidad y a su adaptabilidad a condiciones adversas. Además de su contribución como fuente de forraje de calidad, su incorporación en la rotación beneficia la sostenibilidad de los sistemas mixtos al aumentar la fertilidad del suelo, reducir la erosión, mejorar la retención de agua y contribuir al control de plagas y enfermedades. Por otra parte, en los últimos años el sorgo granífero se ha consolidado como un commodity relevante en los mercados agroexportadores globales, siendo principalmente materia prima para la industria productora de alimentos balanceados (Jáuregui, 2024).
A partir del ciclo agrícola 2020/21, el cultivo de sorgo en Argentina volvió a cobrar protagonismo debido al incremento de la superficie sembrada lo cual estuvo originado principalmente en la demanda por parte de la República Popular China. En la provincia de Entre Ríos, de 67.600 ha en el ciclo 2019/20, se pasaron a 139.000 ha al siguiente, la más alta desde el ciclo 2011/12 (SIBER, 2023). Esto motivó a la Estación Experimental Agropecuaria (EEA) Paraná del Instituto Nacional de Tecnología Agropecuaria (INTA) a responder consultas técnicas con una frecuencia mayor a la habitual y realizar monitoreos del cultivo en su zona de influencia.
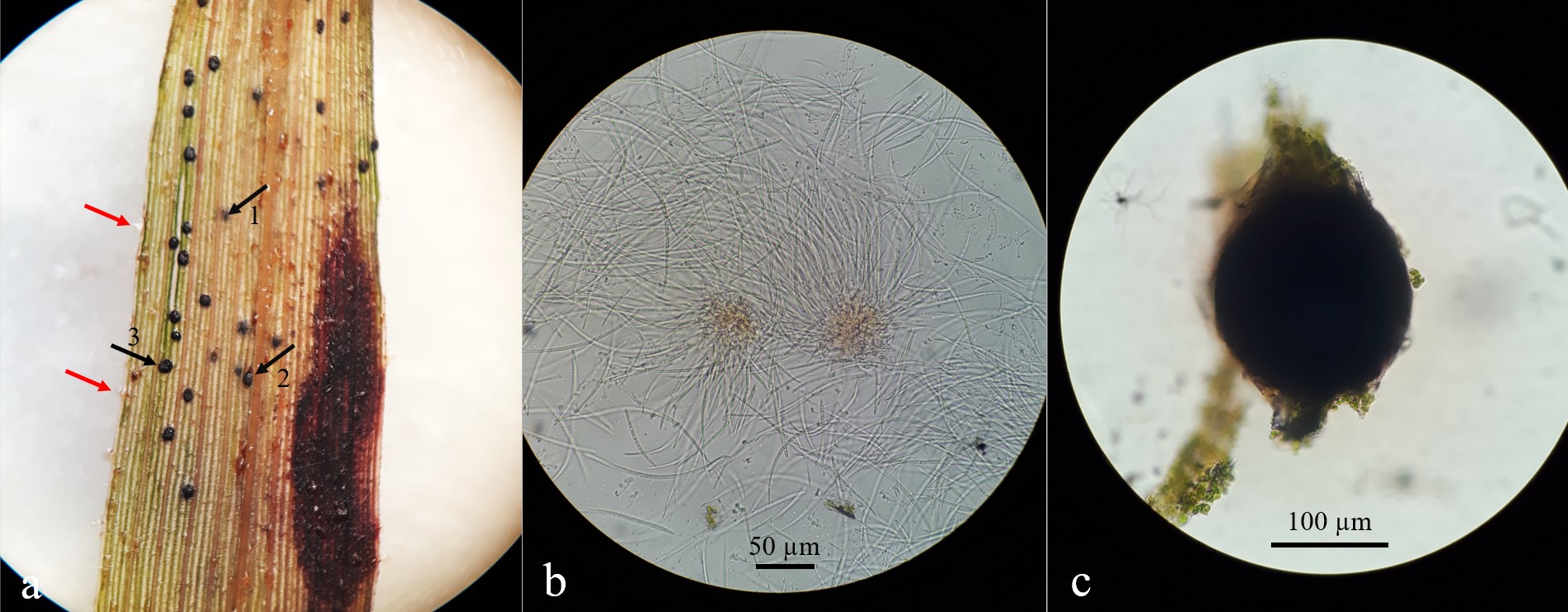
En un recorrido fitosanitario a comienzos de diciembre de 2021 en el departamento La Paz, noroeste de Entre Ríos (30° 45’ 12,69” S - 59° 31’ 54,36” O), se observaron plantas de un cultivo en el estado fenológico 2 (5 hojas completamente expandidas, según la escala fenológica de Vanderlip, 1993), con hojas que presentaban áreas con atizonamiento rodeadas de un leve amarillamiento, abarcando todo el ancho de la lámina desde el ápice y hasta la mitad de la misma. En todos los casos, estas áreas incluían pequeñas manchas, de 3,9 (1,0-9,0 ± 2,0) mm de largo por 1,6 (1,0-3,0 ± 0,6) mm de ancho (n = 22), castaño oscuras, algunas con el centro más claro, más o menos regulares, semicirculares a elípticas o alargadas y, en general, delimitadas por las nervaduras foliares (Figura 1).
Las observaciones preliminares realizadas en el Laboratorio de Patología Vegetal de la EEA Paraná del INTA identificaron, como organismo asociado a estos síntomas, a un hongo productor de esporodoquios y microesclerocios.
Los objetivos del trabajo fueron caracterizar biológicamente e identificar el organismo causal de una enfermedad foliar observada en plantas de sorgo provenientes del noroeste de Entre Ríos.

Materiales y Métodos
Aislamiento y cultivo del agente etiológico
A partir de hojas con síntomas se extrajeron secciones de aproximadamente 10 x 5 mm, se desinfestaron con alcohol 70° durante 30 segundos e hipoclorito de sodio 1 % durante 2 minutos, se enjuagaron con agua destilada estéril y se secaron en cámara de flujo laminar para la confección de cámaras húmedas. Las mismas se colocaron en estufa por 48 horas a 26 ± 1 °C y en oscuridad con la finalidad de favorecer el desarrollo de posibles estructuras fúngicas. Los cultivos puros se obtuvieron mediante la transferencia de esporodoquios a cajas de Petri con agar papa glucosado al 2 % (APG), mientras que la incubación se realizó bajo las mismas condiciones utilizadas para las cámaras húmedas. Las colonias obtenidas se repicaron periódicamente en APG tantas veces como fue necesario hasta obtener aislamientos puros del hongo.
Caracterización del agente etiológico
A partir de tejidos vegetales enfermos colocados en cámara húmeda y de colonias fúngicas desarrolladas en APG, se determinaron la morfología, el color y los valores biométricos de conidios (largo, ancho y número de septos) y microesclerocios (diámetro). Las colonias se incubaron bajo dos regímenes de fotoperíodo: a) 12 horas de luz blanca fluorescente + luz cercana a la ultravioleta (NUV) y 12 horas de oscuridad, y b) 24 horas de oscuridad. Las observaciones se realizaron utilizando un microscopio óptico con un aumento de 400 X, mientras que los valores biométricos de conidios y microesclerocios se determinaron con el programa MICAM (2020) a partir de fotografías obtenidas directamente del microscopio.
Las características de las colonias, como morfología, color, diámetro y tasa diaria de crecimiento, se registraron sobre colonias desarrolladas en cajas de Petri conteniendo APG. Para ello, en el centro de cada una se inoculó con el hongo y se incubó a 26 ± 1 °C bajo un régimen diario de 12 horas de luz blanca fluorescente + luz NUV y 12 horas de oscuridad. A los 1, 2, 3, 6, 7, 9 y 10 días se determinó el diámetro de cada colonia considerando su margen de avance (French y Hebert, 1980) y se calculó la tasa diaria de crecimiento.
Prueba de patogenicidad
Con la finalidad de cumplir con los postulados de Koch se realizó una prueba de patogenicidad con el organismo aislado basada en la metodología de Heo et al. (1999). Las inoculaciones se realizaron sobre plantas sanas del híbrido TOB 62 T, en el estado fenológico de 2 hojas expandidas (27 días desde la siembra) y obtenidas a partir de la siembra, en 6 macetas plásticas de 1 litro con tierra fértil, de 5 semillas por maceta, quedando un total de 30 plantas. Las mismas permanecieron a 26 ± 1 °C y fotoperíodo de 12 horas de luz blanca fluorescente + luz NUV y 12 horas de oscuridad hasta el momento de la inoculación. Como inóculo se utilizó una caja de Petri con una colonia del hongo de 29 días crecida en oscuridad. Su contenido (medio, micelio y estructuras reproductivas) se desmenuzó manualmente, se adicionaron 250 ml de agua destilada estéril, se mezcló con agitador magnético durante 30 minutos y el líquido resultante se asperjó sobre 4 macetas (total de 20 plantas) empleando un pulverizador manual. El tratamiento testigo consistió en asperjar una mezcla de medio APG sin el hongo más agua destilada estéril, sobre 2 macetas (total de 10 plantas). Seguidamente, cada maceta se cubrió por 48 horas con una bolsa de polietileno ligeramente humedecida en su interior y se dejó bajo las mismas condiciones que las empleadas para el crecimiento de las plantas. Finalizada la inoculación, se realizó la observación diaria de síntomas. A partir de los síntomas obtenidos se procedió al reaislamiento del hongo inoculado. Para ello, a los 16 días, se extrajeron los tejidos enfermos, se desinfectaron, se realizaron cámaras húmedas y siembras en APG, y se incubaron a 26 ± 1 °C y en oscuridad.
En todos los casos, los valores biométricos obtenidos se analizaron con el paquete InfoStat v. 2020 (Di Rienzo et al., 2020) para obtener las medidas resumen (número de observaciones, media, valor mínimo, valor máximo y desviación estándar).
Resultados
Aislamiento y caracterización del agente etiológico
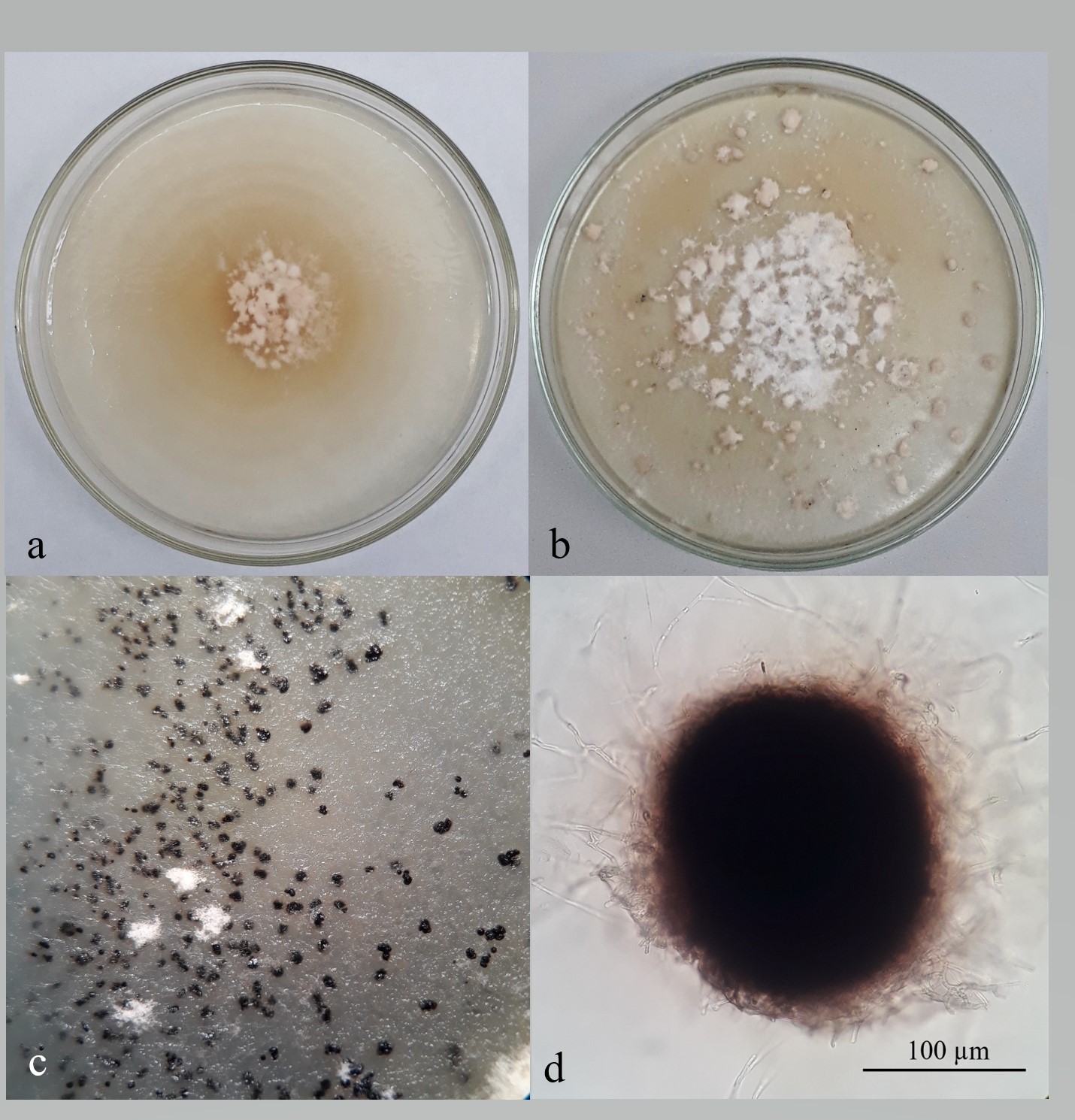
Sobre los tejidos con síntomas colocados en cámara húmeda, al tercer día se observó el desarrollo de una abundante esporulación anaranjado-rosácea y de consistencia gelatinosa o viscosa (Figura 2a), en el interior y alrededor de las lesiones. El análisis microscópico reveló la existencia de esporodoquios con conidióforos cortos, densamente agrupados y de difícil medición, y conidios hialinos, simples, filiformes, flexuosos, multiseptados, estrechándose desde la base hasta el ápice (Figura 2b). Los conidios (n = 120), a las 72 horas de la incubación de los tejidos, midieron 114,6 (61,4-172,0 ± 19,8) µm de largo y 2,6 (1,6-3,4 ± 0,3) µm de ancho, y presentaron 10 (7-12) septos. Simultáneamente, se observaron microesclerocios negros, dispersos, subepidérmicos, inmersos en el mesófilo y no erumpentes, ovales a esféricos, de aproximadamente 0,2 mm de diámetro y que se desarrollaron independientemente de los esporodoquios (Figura 2c). A los 12 días, fue común observar que los microesclerocios liberaban masas de conidios (Figura 2d), los cuales no difirieron de los producidos por los esporodoquios.

Las colonias desarrolladas en APG e incubadas bajo el régimen de 12 horas de luz blanca fluorescente + luz NUV y 12 horas de oscuridad, inicialmente fueron delgadas y presentaron micelio aéreo escaso y anillos concéntricos de crecimiento. Posteriormente, el micelio se tornó algodonoso en el centro de las colonias y se observaron masas gelatinosas rosáceas dispersas que consistieron conidios (Figuras 3a y 3b). Estos últimos, a los 35 días, midieron 65,8 (33,6-110,9 ± 16,0) µm de largo por 2,8 (1,8-3,1 ± 0,2) µm de ancho y presentaron 8 (6-10) septos (n = 105). El crecimiento de estas colonias (n = 3) fue rápido, con un promedio de 76,8 (76,5-77,0 ± 0,3) mm de diámetro a los 10 días y una tasa de crecimiento de 7,4 (7,3-7,6 ± 0,1) mm día-1. Por otra parte, en colonias de 9 días e incubadas en oscuridad, se detectaron numerosos microesclerocios similares a los observados en los tejidos enfermos, inmersos en el medio o dispuestos superficialmente (Figuras 3c y 3d); estos, a los 21 días, midieron 187,6 (132,0-265,0 ± 44,3) por 220,7 (149,0-295,0 ± 46,6) µm de diámetro (n = 20). A diferencia de lo hallado in vivo, no se observaron masas de conidios emergiendo desde los microesclerocios.
Prueba de patogenicidad
Todas las plantas inoculadas manifestaron síntomas a los 2 días y consistieron en pequeñas manchas alargadas, de 3 x 1 mm aproximadamente, de aspecto húmedo, paralelas a las nervaduras y delimitadas por estas, situadas generalmente en los márgenes de las hojas, de una coloración castaño-clara con el centro más oscuro y rodeadas de un verde pálido (Figura 4a). Posteriormente, estas lesiones evolucionaron y se tornaron irregulares, aumentando de tamaño, tanto de ancho como de largo. A los 6 días, presentaron el centro oscuro rodeado de un área necrótica más clara y delimitada por un margen rojizo. Asimismo, el área circundante de la mancha se tornó más clorótica (Figura 4b). A los 9 días, se observaron delgadas bandas rojizas alternando con áreas castaño-claras a grisáceas, con márgenes más o menos difusos, y rodeadas de un halo amarillento (Figura 4c). A los 14 días, las lesiones presentaron áreas necróticas irregulares y grisáceas, con delgadas bandas rojizas en su interior y coincidentes con las nervaduras, y abarcando casi todo el ancho de la lámina foliar, dando el aspecto de anillos o círculos, en algunos casos “deformados” (Figura 4d). Las plantas del tratamiento testigo no presentaron síntomas ni signos de la enfermedad.

Los tejidos con síntomas resultantes de la prueba de patogenicidad y colocados en cámara húmeda, a partir del cuarto día produjeron esporodoquios con conidios. Además, microesclerocios negros, globosos, que emergían desde el interior de los tejidos, quedando luego en su mayoría dispuestos superficialmente (Figura 5). El hongo inoculado se reaisló en APG, reproduciendo las mismas características detalladas anteriormente.
Discusión
Las características de los conidios y microesclerocios provenientes de tejidos infectados naturalmente y de la prueba de patogenicidad, así como las características de las colonias, coincidieron en gran parte con las descripciones de la mayoría de los autores (Bain y Edgerton, 1943; Ciccarone, 1949; Muntañola, 1954; Dean, 1968; Franklin, 1986; Arsenijević et al., 1996; Heo et al., 1999; Jiang et al., 2018; Stewart et al., 2019) para Microdochium sorghi (= Gloeocercospora sorghi). Este hongo ocasiona la enfermedad del sorgo denominada “mancha zonada de la hoja”, “mancha concéntrica” o “zonate leaf spot”.
La enfermedad fue registrada por primera vez en 1940 sobre variedades de sorgo dulce (S. bicolor var. saccharatum), en Louisina (EEUU), por Bain y Edgerton (1943). Estos autores crearon el género Gloeocercospora y describieron el hongo denominándolo G. sorghi. Aunque el Fungal Names (2023) y el Index Fungorum (2023) consideran como nombre válido a G. sorghi, MycoBank (2023) y diversos autores (Hernández-Restrepo et al., 2016; Stewart et al., 2019; Liu et al., 2022; Ünal, 2024), lo ubican taxonómicamente en el género Microdochium, denominándolo G. sorghi. El patógeno afecta a hospedantes de la familia Poaceae, principalmente del género Sorghum, entre ellas el sorgo común y el sorgo de Alepo (S. halepense), además de los géneros Agrostis, Cynodon, Pennisetum, Saccharum, Sorghastrum, Tripsacum, Vetiveria y Zea (Braun, 1995; Farr y Rossman, 2022).
En Argentina, la enfermedad fue determinada por primera vez en 1951, en la provincia de Tucumán, por Muntañola (1954) quien realizó una exhaustiva descripción de los síntomas en variedades de sorgos azucarados y sorgo Sudán (S. x drummondii), caracterizando el agente etiológico y señalando las condiciones favorables para su desarrollo. Casi simultáneamente, Tessi y Frecha (1953) la citaron para el centro y nordeste del país sobre sorgos azucarados, sorgo Sudán y diferentes variedades de sorgo granífero. Giorda (2002) la clasificó como un “problema ocasional” para la región sorguera argentina.
Un hongo similar, Ramulispora sorghi, ocasiona la “mancha de hollín” o “sooty stripe” y produce esporodoquios y microesclerocios al igual que G.sorghi. Sin embargo, se distingue por sus conidios ramificados y porque sus esporodoquios se originan a partir de un estroma subepidérmico que luego erupcionan a través de los estomas, mientras que los de M. sorghi son superficiales. Por otra parte, los microesclerocios de M. sorghi se forman en el interior de los tejidos muertos, mientras que los de R. sorghi se originan en la superficie y son de fácil desprendimiento (Tarr, 1962; Rawla, 1973; Doggett, 1988; Braun, 1995; Heo et al., 1999; Cúndom et al., 2016; Velazquez, 2020). Si bien en la prueba de patogenicidad se detectaron microesclerocios superficiales de M. sorghi, la observación diaria logró constatar su origen subepidérmico, corroborando lo descrito por otros autores.
En general, los síntomas típicos o más notorios de la enfermedad consisten en manchas circulares o semicirculares, de diámetro variable (3-7 cm), con bandas o anillos púrpuras o rojizos que alternan de manera concéntrica con bandas castaño-claras a oscuras o grisáceas (Muntañola, 1954; Tarr, 1962; Horne y Berry, 1980; Franklin, 1986; Giorda, 1997; Heo et al., 1999; Da Silva Ferreira et al., 2007; Stewart et al., 2019). Esta manifestación de la enfermedad corresponde a lesiones bien desarrolladas y es la que le da el nombre de “mancha zonada de la hoja” o “mancha concéntrica”, permitiendo distinguirla de otras patologías del sorgo. Además de los síntomas típicos, Muntañola (1954) describió otros dos tipos de manchas en hojas infectadas naturalmente: a) ovaladas, de 4 x 2,5 mm, con márgenes rojizo anaranjado y centro más claro, y b) alargadas, de 20 x 5 mm, delimitadas por nervaduras, con áreas rojizas y castaño claras alternadas. De igual manera, Tessi y Frecha (1953) describieron manchas con características similares a estas últimas en variedades de sorgo.
Muntañola (1954) demostró que la humedad relativa ambiente es el principal factor en el desarrollo de la enfermedad. Cuando la misma no es suficiente, las lesiones progresan lentamente y no forman los típicos círculos concéntricos. Por otra parte, y tal como ocurrió en las inoculaciones, plantas infectadas y mantenidas en un ambiente saturado de humedad producen esporodoquios de manera abundante y manifiestan lesiones entre las 24 y 48 horas aumentando rápidamente su tamaño en los días subsiguientes, dando lugar a la aparición de los síntomas típicos (Bain y Edgerton, 1943; Ciccarone, 1949). En consecuencia, es probable que los niveles de humedad presentados a campo no hayan sido suficientes para el desarrollo completo de las lesiones, lo cual favoreció la aparición de manchas ovaladas y alargadas similares a las descritas anteriormente por Muntañola (1954).
En regiones con períodos húmedos, la ocurrencia de la enfermedad es frecuente, presentando además un alto potencial destructivo (Panizzi et al., 2005; Da Silva Ferreira et al., 2007). Al igual que otras enfermedades del sorgo, el posible impacto negativo sobre la producción dependerá tanto de la incidencia como de la severidad, las que a su vez estarán condicionadas principalmente por la disponibilidad de inóculo, la susceptibilidad de los híbridos, las prácticas culturales, las condiciones climáticas prevalecientes, así como de la interacción de estos factores (Giorda, 1997).
A los fines de corroborar la identidad del organismo causal de la enfermedad, es necesario complementar la caracterización biológica con técnicas moleculares.
Conclusiones
Las características de los conidios y microesclerocios desarrollados in vivo e in vitro, así como las de las colonias y la sintomatología observada en la prueba de patogenicidad, confirmaron a M. sorghi como el organismo causal de las manchas foliares halladas en sorgo. La información obtenida contribuye al conocimiento de la “mancha zonada de la hoja” o “mancha concéntrica” del sorgo y reafirma la importancia de realizar un correcto diagnóstico de enfermedades en este cultivo.
Agradecimientos
Al Proyecto Disciplinario INTA “Análisis de patosistemas en cultivos agrícolas y especies forestales. Caracterización de sus componentes” (2019-PD-E4-I090-001).
Referencias
Arsenijević, M., Petrović, T., & Lević, J. (1996). Gloeocercospora sorghi a new pathogen of Johnsongrass for Yugoslavia. Zaštita Bilja, 47(2), 216, 141-147.
Bain, D.C., & Edgerton, C.W. (1943). The zonate leaf spot, a new disease of sorghum. Phytopathology 33, 220-226.
Braun, U. (1995). A monograph of Cercosporella, Ramularia, and allied genera (phytopathogenic Hyphomycetes). Vol. 1. IHW-Verlag, München. 333 p.
Ciccarone, A. (1949). Zonate Leaf Spot of Sorghum in Venezuela. Phytopathology, 39, 760-761.
Cúndom, M.A., Namtz, Y., & Gutiérrez, S.A. (2016). Ramulispora sorghi patógeno en cultivos de sorgo del NE de Argentina. Summa Phytopathologica, 42(2), 183-184.
Da Silva Ferreira, A., Casela, C.R., & De Almeida Pinto, N.F.J. (2007). Manejo de doenças na cultura do sorgo. Embrapa Milho e Sorgo. Circular Técnica 89. 20 p. https://www.embrapa.br/busca-de-publicacoes/-/publicacao/486484/manejo-de-doencas-na-cultura-do-sorgo.
Dean, J.L. (1968). Germination and overwintering of sclerotia of Gloeocercospora sorghi. Phytopathology, 58, 113-114.
Di Rienzo, J.A., Casanoves, F., Balzarini, M.G., González, L., Tablada, M., & Robledo, C.W. (2020). InfoStat versión 2020. Centro de Transferencia InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. https://www.infostat.com.ar/
Doggett, H. (1988). Sorghum diseases. Chapter 11. In: Sorghum. 2nd Edition. Longman Scientific & Technical. pp. 343-367.
Farr, D.F., & Rossman, A.Y. (2022). Fungal Databases, U.S. National Fungus Collections, ARS, USDA. https://nt.ars-grin.gov/fungaldatabases/
Franklin, D.D. (1986). Zonate Leaf Spot. In: Frederiksen, R.A. (Ed.). Compendium of Sorghum diseases. APS Press, St. Paul, MN. pp. 12-13.
French, E.R., & Hebert, T.T. (1980). Métodos de investigación fitopatológica. IICA, San José, Costa Rica, 289 p.
Fungal Names (2023). Gloeocercospora sorghi. https://nmdc.cn/fungalnames/namesearch/toallfungalinfo?recordNumber=286676
Giorda, L.M. (1997). Sorgo granífero. Cuaderno de Actualización Técnica N° 7. Centro Regional Córdoba. INTA EEA Manfredi. 71 p.
Giorda, L.M. (2002). Sorghum Diseases in Argentina. In: Leslie, J.F. (Ed.). Sorghum and Millet Diseases. Iowa State Press, Ames, Iowa. pp. 389-392.
Heo, C., Kim, J.-N., Hyun, I.-H., & Heo, N.-Y. (1999). Zonate leaf spot of Sorghum caused by Gloeocercospora sorghi in Korea. The Plant Pathology Journal, 15(4), 242-246.
Hernández-Restrepo, M., Groenewald, J.Z., & Crous, P.W. (2016). Taxonomic and phylogenetic re-evaluation of Microdochium, Monographella and Idriella. Persoonia, 36, 57-82. https://doi.org/10.3767/003158516X688676
Horne, C.W., & Berry, R.W. (1980). Sorghum disease atlas. Texas Agricultural Extension Service, The Texas A&M University System. B-1323. 16 p.
Index Fungorum (2023). Microdochium sorghi. https://www.indexfungorum.org/names/NamesRecord.asp?RecordID=413460
Jáuregui, J.M. (2024). Bueno, robusto y versátil: el sorgo saca chapa en la ganadería. Revista AAPRESID, 226, 100-107. https://issuu.com/aapresid/docs/revista_aapresid_226
Jiang, Y., Xu, J., Hu, L., Liu, K.-J., Xu, X.-D., Liu, Z., & Meng, W.L. (2018). First report of Sorghum zonate leaf spot caused by Gloeocercospora sorghi in China. Plant Disease, 102 (5), 1033 https://doi.org/10.1094/PDIS-08-17-1217-PDN
Liu, S., Liu, X., Zhang, Z., Xia, J., Zhang, X., & Meng, Z. (2022). New species of Microdochium (Sordariomycetes, Amphisphaeriales) on Miscanthus sinensis and Phragmites australis from Hainan, China. J. Fungi, 8(6), 577. https://doi.org/10.3390/jof8060577
MICAM (2020). Microscope Image Capture and Measurement. Version 3.0.2. http://science4all.nl/?Microscopy_and_Photography.
Muntañola, M. (1954). Bacterias y hongos que atacan a los sorgos cultivados en la provincial de Tucumán. Revista Agronómica del Noroeste Argentino, 1(2), 99-133.
Mycobank (2023). Microdochium sorghi. https://www.mycobank.org/page/Name%20details%20page/field/Mycobank%20%23/413460
Panizzi, R.C., Fernandes, N.G., & Camargo, N. (2005). Doenças do sorgo (Sorghum bicolor). En: Kimati H., Amorin L., Rezende J.A.M., Bergamin Filho A. y L.E.A. Camargo (Eds.). Manual de Fitopatologia. Vol. 2: doenças das plantas cultivadas. Editora Agronômica Ceres Ltda. São Paulo. Cap. 66, 597-606.
Rawla, G.S. (1973). Gloeocercospora and Ramulispora in India. Trans. Br. Mycol. Soc., 60(12), 283-292.
SIBER (2023). Informe de Producción de Sorgo - Campaña 2022/23. Bolsa de Cereales de Entre Ríos. https://www.bolsacer.org.ar/Fuentes/siberd.php?Id=1485
Stewart, S., Rodríguez, M., Mattos, N., & Abreo, E. (2019). First report of zonate leaf spot in Sorghum caused by Microdochium sorghi in Uruguay. Agrociencia Uruguay, 23(2), 1-5. https://doi.org/10.31285/AGRO.23.74
Tarr, S.A.J. (1962). Zonate leaf spot. Foliage Diseases 1. Diseases of Sorghum, Sudan Grass and Broom Corn. CAB. Kew, Surrey. pp. 133-137.
Tessi, J.L., & Frecha, J.H. (1953). Algunos hongos que parasitan las hojas de los sorgos en la Argentina. IDIA, 5(61), 5-8.
Ünal, F. (2024). Phylogenetic analysis of Microdochium spp. associated with turfgrass and their pathogenicity in cereals. PeerJ 12:e16837. https://doi.org/10.7717/peerj.16837
Vanderlip, R.L. (1993). How a Sorghum Plant Develops, Kansas State University, Agricultural Experiment Station and Cooperative Extension Service. https://bookstore.ksre.ksu.edu/pubs/s3.pdf.
Velazquez, P.D. (2020). Detección de mancha de hollín del sorgo por Ramulispora sorghi en la provincia de Entre Ríos. Serie Extensión INTA Paraná, 86, 32-36. https://repositorio.inta.gob.ar/handle/20.500.12123/8489

