Artículos originales
Capacidad de Lactiplantibacillus plantarum LP5 para inhibir biopelículas de Campylobacter coli
Ability of Lactiplantibacillus plantarum LP5 to inhibit biofilms of Campylobacter coli
Capacidad de Lactiplantibacillus plantarum LP5 para inhibir biopelículas de Campylobacter coli
FAVE Sección Ciencias Veterinarias, vol. 21, e0002, 2022
Universidad Nacional del Litoral

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.
Recepción: 25 Agosto 2021
Aprobación: 07 Marzo 2022
Resumen: El objetivo de este estudio fue evaluar la capacidad inhibitoria de Lactiplantibacillus plantarum LP5 frente a Campylobacter coli en ensayos de formación de biopelículas in vitro y exclusión competitiva. La formación de biopelículas por C. coli NCTC11366, C. coli DSPV458, C. coli DSPV541 y C. coli DSPV570 fue evaluada mediante medición de DO. La capacidad inhibitoria de L. plantarum LP5 frente a C. coli fue evaluada sobre discos de vidrio, nailon y aluminio. Sobre una biopelícula de L. plantarum se adicionó C. coli para cuantificar el efecto inhibidor de L. plantarum LP5 sobre el patógeno. Las cuatro cepas de C. coli fueron clasificadas como moderadas formadoras de biopelículas. El ensayo de exclusión competitiva mostró que la formación de biopelículas de las cepas de C. coli en todos los materiales fue significativamente mayor que la formación de biopelículas de cada patógeno en presencia de biopelículas de L. plantarum LP5. Si bien es necesario realizar más pruebas para confirmar la capacidad de supervivencia de C. coli en ambientes hostiles hasta llegar al huésped, este estudio permitiría avanzar en el esclarecimiento de su comportamiento mediante la formación de biopelículas.
Palabras clave: biopelículas, Campylobacter coli, Lactiplantibacillus plantarum, superficie abiótica.
Abstract: The objective of this study was to evaluate the inhibitory capacity of Lactiplantibacillus plantarum LP5 against Campylobacter coli in in vitro biofilm formation and competitive exclusion assays. Biofilm formation by C. coli NCTC11366, C. coli DSPV458, C. coli DSPV541 and C. coli DSPV570 was evaluated by OD measurement. The inhibitory capacity of L. plantarum LP5 against C. coli was evaluated on glass, nylon and aluminium discs, added with L. plantarum and incubated at 37°C for 72 h. C. coli was added to each washed well. The plates were incubated at 42°C for 72 h in microaerophilic conditions and the biofilms were detached for quantification. The four strains of C. coli were classified as moderate biofilm former. The competitive exclusion test showed that the biofilm formation of the C. coli strains in all materials was significantly higher than the biofilm formation of each pathogen in the presence of L. plantarum LP5 biofilms. Although it is necessary to carry out more tests to confirm the ability of C. coli to survive in hostile environments until reaching the host, this study would allow progress in the elucidation of its behaviour through the formation of biofilms.
Keywords: biofilms, Campylobacter coli, Lactiplantibacillus plantarum, abiotic surface.
Introducción
Campylobacter termotolerantes (CT) forma parte de la microbiota del tracto gastrointestinal de los animales productores de alimentos, principalmente las aves de corral. Las infecciones en humanos por Campylobacter ocurren directamente por contacto de la persona con heces de animales, o indirectamente por el consumo de alimentos de origen animal poco cocidos o por contaminación cruzada con alimentos preparados listos para el consumo (Reeser et al., 2007). Si bien CT no logra sobrevivir en el aire atmosférico por más de unas pocas horas, se cree que desarrolla estrategias de adaptación para permanecer en estas condiciones, tales como la formación de biopelículas (Sualeman et al., 2010). Una biopelícula es una agregación de células estructurada en una matriz polimérica extracelular heterogénea unida a una superficie sólida. Las biopelículas pueden formarse sobre diferentes materiales como vidrio, nailon, aluminio, madera, plástico, acero inoxidable e incluso sobre los alimentos y pueden persistir frente a los procesos de limpieza y desinfección (Cáceres, 2019). La formación de biopelículas puede desempeñar un papel importante en la supervivencia de Campylobacter en el medio ambiente (Kalmokof et al., 2006). Estas comunidades bacterianas, presentan ventajas adaptativas respecto a las bacterias planctónicas como protección frente a agentes adversos, disponibilidad de nutrientes, aprovechamiento del agua -reduciendo la posibilidad de deshidratación- y transferencia de material genético (Cáceres et al., 2019). Así también, la biopelícula proporciona protección contra agentes sanitizantes, mejora la supervivencia y optimiza la multiplicación microbiana, siendo un atributo microbiano de resiliencia. CT tienen la capacidad de formar biopelículas en los equipos e instalaciones de cría y plantas de procesamiento de animales (Reeser et al., 2007). Los principales sitios de desarrollo de biopelículas dependen del tipo de fábrica, pero pueden incluir tuberías de agua, leche y otros líquidos, placas pasteurizadoras, membranas de ósmosis inversa, mesas, guantes, cadáveres de animales, superficies de contacto, silos de almacenamiento de materias primas y aditivos, material de empaque, entre otros (Camargo et al., 2017). En la industria alimentaria, la presencia de biopelículas es un factor de riesgo debido a la posible contaminación de los productos alimenticios con microorganismos patógenos y alterantes. Ante este contexto, existe un gran interés en el desarrollo de nuevas estrategias que utilicen productos naturales para controlar la persistencia de patógenos en la industria alimentaria. Las biopelículas formadas por bacterias ácido lácticas (BAL) pueden ser utilizadas para reducir patógenos (Gómez, 2016). Este enfoque prometedor basado en el principio de exclusión competitiva permitiría colonizar superficies con el fin de contrarrestar la proliferación y establecimiento de bacterias patógenas. Por ello, el objetivo de este estudio fue evaluar la capacidad inhibitoria de Lactiplantibacillus plantarum LP5 frente a Campylobacter coli en ensayos de formación de biopelículas in vitro y exclusión competitiva.
Materiales y métodos
Selección y condiciones de crecimiento de las cepas
Se utilizaron 4 cepas de Campylobacter coli y una cepa de L. plantarum. Todas las cepas fueron conservadas en medios crioprotectores a -80°C antes de su uso.
Las cepas de Campylobacter coli seleccionadas fueron: C. coli NCTC11366 (de referencia, cedida por la Dra. Marta Cerdà-Cuéllar Laboratorio de Microbiología, CRESA, IRTA), C. coli DSPV458 (aislada de moscas), C. coli DSPV541 (aislada de aves de corral) y C. coli DSPV570 (aislada de cerdo). Estas últimas cepas de tipo salvaje fueron aisladas en el Laboratorio de Análisis de Alimentos, ICIVET, UNL y se seleccionaron en función de la virulencia y el perfil genético previamente estudiados (Rossler et al., 2017). Las cuatro cepas seleccionadas fueron activadas en placas con medio CCDA (Charcoal Cefoperozone Deoxycholate Agar, Oxoid, Reino Unido) durante 48 h a 42°C en microaerofilia.
L. plantarum LP5 de origen porcino fue identificada previamente por secuenciación de Sanger del 16S ribosomal y seleccionada debido a su actividad antibacteriana in vitro e in vivo contra patógenos involucrados en brotes alimentarios, entre ellos C. coli (Ruiz et al, 2021). L. plantarum LP5 forma biopelículas a temperatura ambiente y bajo condiciones de refrigeración (Ruiz, 2019) y fue activado en caldo MRS (de Man, Rogosa y Sharpe, Biokar, Francia) durante 24 h a 37°C en aerobiosis.
Formación de biopelículas por C. coli
La cuantificación de la producción de biopelículas fue realizada según Reeser (2007) con algunas modificaciones. En una placa de valoración de poliestireno estéril de 24 pocillos (Cat 662160 Cellstar® 24 Well Cell Culture Plate sterile with lid, Greiner Bio-One) fueron colocados 2 ml de caldo Muller Hinton (MH, Biokar, Francia) y 200 µl de una suspensión bacteriana en ese medio de cultivo ajustada a una densidad óptica (DO) de 0,25±0,05 (A600nm). La concentración bacteriana fue estandarizada a 107-108 UFC/ml. La placa fue incubada en microaerofilia durante 72 h a 42°C. El medio fue retirado de los pocillos y estos fueron lavados suavemente con 2 ml de agua destilada estéril. Las bacterias adheridas fueron fijadas con 2 ml de metanol (Anedra, Argentina) durante 15 min. Las placas fueron vaciadas y secadas a temperatura ambiente. Cada pocillo fue adicionado con 2 ml de una solución de cristal violeta (Anedra, Argentina) al 2% (v/v) y mantenido a temperatura ambiente durante 5 min. El colorante fue eliminado mediante un suave enjuague con agua corriente y la tinción de las células adherentes fue liberada con 2 ml de ácido acético glacial al 33% (v/v). Finalmente fue medida la densidad óptica (DO) de cada pocillo a 600nm usando un lector de placas (CLARIOstar®Plus, BMG LABTECH, Argentina). El control negativo fue realizado en pocillos conteniendo caldo MH (Biokar, Francia) sin inocular y el valor medio de DO de 6 réplicas fue utilizado para establecer los diferentes puntos de corte (CDO). Con base en la DO obtenida, las cepas fueron clasificadas como: no formadoras de biopelículas (NF): DO≤CDO, débiles formadoras de biopelículas (DF): CDO
Inhibición de la formación de biopelículas
La capacidad inhibitoria de L. plantarum LP5 frente a C. coli fue evaluada según Gómez (2016) con modificaciones. En tres placas de poliestireno de 24 pocillos fueron colocados discos estériles de 12 mm de diámetro y 1 mm de espesor de diferentes materiales: vidrio, nailon y aluminio, sobre los que se adicionaron 2 ml de caldo MRS (Biokar, Francia) y 200 µl de L. plantarum con una densidad óptica de 0,25±0,05 (A600nm). Las placas fueron incubadas a 37°C durante 72 h. Los caldos fueron descartados con pipeta y cada pocillo fue lavado suavemente con 2 ml de PBS pH7,1 (Na2HPO4 10mM, KH2PO4 1mM, NaCl 140mM, KCl 3mM) para eliminar las bacterias planctónicas. Posteriormente, 2 ml de caldo MH y 200 µl de suspensiones de las distintas cepas de C. coli (C. coli NCTC11366, C. coli DSPV458, C. coli DSPV 541 y C. coli DSPV570) ajustadas a una densidad óptica de 0,25±0,05 (A600nm) fueron adicionados a cada pocillo. Las placas fueron incubadas a 42°C durante 72 h en microaerofilia. Posteriormente, cada disco fue extraído, lavado con 1 ml de PBS con pipeta y colocado en un tubo Falcon de 50 ml con 5 ml de solución de cloruro de sodio (Biopack, Argentina) al 0,85% (p/v). Los tubos fueron agitados a 250 rpm de velocidad en un agitador lineal (SK L330-Pro, DragonLab, Argentina) y las diluciones decimales en solución de cloruro de sodio al 0,85% (p/v) fueron sembradas en agar CCDA (Oxoid, Reino Unido) para el recuento de C. coli y en agar MRS (Biokar, Francia) para el recuento de L. plantarum LP5. Luego de la incubación por 48 h a 42°C en microaerofilia y por 72 h a 37°C en aerobiosis, respectivamente, fueron realizados los recuentos bacterianos y expresados en log10UFC/disco. El tratamiento control de desarrollo de biopelículas por C. coli fue realizado mediante su incorporación a los pocillos sin la presencia de L. plantarum LP5. El límite de detección de la técnica fue de 1,7 log10UFC/disco.
Análisis estadístico
El ensayo de inhibición de formación de biopelículas fue realizado por triplicado. Los recuentos de C. coli en biopelículas del patógeno y de C. coli frente a L. plantarum LP5 fueron analizados mediante un ANOVA y una prueba de Tukey para evaluar diferencias entre los materiales estudiados.
Resultados
Capacidad de C. coli para formar biopelículas
El valor promedio de CDO fue de 0,130, y los valores promedio de DO para C. coli NCTC11366, C. coli DSPV458, C. coli DSPV541 y C. coli DSPV570 fueron 0,439; 0,309; 0,292 y 0,412, respectivamente. Las cuatro cepas de C. coli fueron clasificadas como moderadas formadoras de biopelículas.
Capacidad de L. plantarum LP5 para reducir biopelículas de C. coli
El ensayo de exclusión competitiva en discos de vidrio mostró una cuantificación promedio de C. coli NCTC11366 solo, y de C. coli NCTC11366 sobre la biopelícula de L. plantarum LP5 de 6,70 log10UFC/disco y 2,97 log10UFC/disco, respectivamente. El recuento de C. coli DSPV458 solo, y de C. coli DSPV458 sobre la biopelícula de L. plantarum LP5 fue de 5,79 log10UFC/disco y 3,03 log10UFC/disco, respectivamente. La cuantificación de C. coli DSPV541 solo, y de C. coli DSPV541 sobre la biopelícula de L. plantarum LP5 fue de 5,16 log10UFC/disco y 3,96 log10UFC/disco, respectivamente. Y el recuento de C. coli DSPV570 solo, y de C. coli DSPV570 sobre la biopelícula de L. plantarum LP5 fue de 6,03 log10UFC/disco y 4,46 log10UFC/disco, respectivamente (Figura 1).
En los discos de nailon la cuantificación promedio de C. coli NCTC11366, y de C. coli NCTC11366 sobre la biopelícula de L. plantarum LP5 fue de 6,70 log10UFC/disco y de 2,11 log10UFC/disco, respectivamente. En C. coli DSPV458 y C. coli DSPV458 sobre la biopelícula de L. plantarum LP5 la cuantificación fue de 5,79 log10UFC/disco y 2,11 log10UFC/disco, respectivamente. En C. coli DSPV541, y C. coli DSPV541 sobre la biopelícula de L. plantarum LP5 fue de 4,37 log10UFC/disco y 1,35 log10UFC/disco, respectivamente. Y en C. coli DSPV570, y C. coli DSPV570 sobre la biopelícula de L. plantarum LP5 fue de 6,70 log10UFC/disco y 2,66 log10UFC/disco, respectivamente (Figura 1).
El análisis sobre los discos de aluminio mostró una cuantificación promedio de C. coli NCTC11366 solo, y de C. coli NCTC11366 sobre la biopelícula de L. plantarum LP5 de 6,70 log10UFC/disco y 2,79 log10UFC/disco, respectivamente. En el resto de las combinaciones C. coli-L. plantarum LP5 no se detectó C. coli luego del tratamiento (Figura 1).
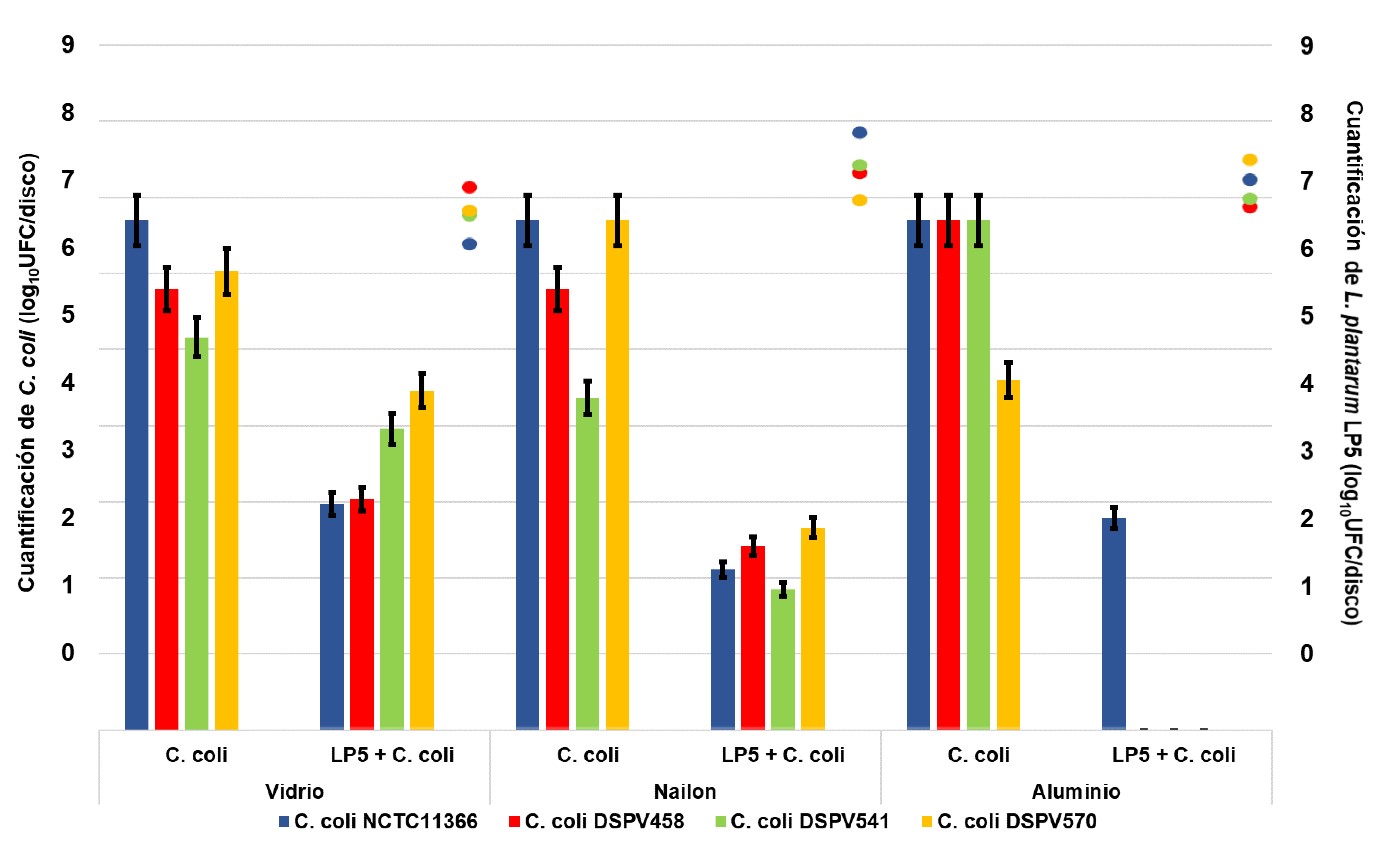
Figura 1.
Cuantificación de C. coli NCTC11366, C. coli DSPV458, C. coli DSPV541 y C. coli DSPV570 en discos de vidrio, nailon y aluminio no tratados y tratados con L. plantarum LP5. Las barras indican la desviación estándar. Las columnas indican la cuantificación de cada C. coli (log10UFC/disco) desprendido desde los discos inoculados sólo con C. coli (C. coli) y desde los discos inoculados con C. coli sobre la biopelícula de L. plantarum LP5 (LP5 + C. coli) formada sobre vidrio, nailon y aluminio. Los puntos indican la cuantificación de L. plantarum LP5 (log10UFC/disco) desprendido desde la biopelícula de L. plantarum LP5 formada sobre vidrio, nailon y aluminio en donde se había inoculado también cada cepa C. coli.
La formación de biopelículas de C. coli NCTC11366, C. coli DSPV458, C. coli DSPV541 y C. coli DSPV570 en todos los materiales fue significativamente mayor que la formación de biopelículas de cada patógeno en presencia de biopelículas de L. plantarum LP5 (p<0,001, p=0,001, p=0,004 y p<0,001, respectivamente).
El recuento de L. plantarum LP5 integrante de biopelícula formada sobre los discos de vidrio en los cuales fue adicionado C. coli NCTC11366, C. coli DSPV458, C. coli DSPV541 y C. coli DSPV570 fue de 6,28 log10UFC/disco, 7,10 log10UFC/disco, 6,69 log10UFC/disco y 6,76 log10UFC/disco, respectivamente. La cuantificación de L. plantarum LP5 en los discos de nailon en los que fue adicionado C. coli NCTC11366, C. coli DSPV458, C. coli DSPV541 y C. coli DSPV570 fue de 7,88 log10UFC/disco, 7,30 log10UFC/disco, 7,42 log10UFC/disco y 6,91 log10UFC/disco, respectivamente. Y el recuento de L. plantarum LP5 en los discos de aluminio sobre los que fue adicionado C. coli NCTC11366, C. coli DSPV458, C. coli DSPV541 y C. coli DSPV570 fue de 7,21 log10UFC/disco, 6,82 log10UFC/disco, 6,93 log10UFC/disco y 7,49 log10UFC/disco, respectivamente (Figura 1).
Respecto a los materiales estudiados, la cuantificación de las biopelículas de C. coli formadas sobre los discos de vidrio, nailon y aluminio inoculados sólo con C. coli, no mostró diferencias (p=0,683). En cambio, las biopelículas de C. coli formadas sobre la biopelícula de L. plantarum LP5 mostraron diferencias entre los materiales. En el aluminio los recuentos fueron menores (p=0,001) que en el nailon y el vidrio.
Discusión
En comparación con muchos otros patógenos causantes de ETA, CT es más sensible a las condiciones ambientales (presión parcial de oxígeno atmosférico, temperaturas inferiores a 30°C, ambiente seco, entre otros). Estas propiedades hacen que la supervivencia de CT fuera del huésped esté dificultada en entornos aeróbicos naturales como en la cadena agroalimentaria. Sin embargo, CT está muy extendido en el medio ambiente y puede aislarse desde los alimentos, el agua y otras fuentes. Si bien no está claro cómo CT supera esas desventajas para sobrevivir en el medio ambiente y la cadena alimentaria para luego causar enfermedades, su capacidad para formar biopelículas podría explicar su supervivencia en ambientes de procesamiento de alimentos. La formación de biopelículas por CT en superficies abióticas es uno de los factores menos comprendidos (Reeser et al., 2007). No obstante, la simple adherencia en superficies y en biopelículas existentes de otras especies microbianas contribuye a la supervivencia de CT en ambientes relacionados con los alimentos. La prevención y control de la adhesión microbiana en las instalaciones, equipos y utensilios requiere de medidas tales como lavado diario y desinfección con sustancias microbicidas aprobadas. El propósito de la desinfección es reducir y evitar la proliferación de la carga microbiana presente en las superficies luego de la limpieza. Los desinfectantes deben ser efectivos, seguros y fáciles de manejar, debiendo eliminarse fácilmente desde las superficies usando agua y sin dejar residuos en el producto final que puedan afectar al consumidor. En este estudio, todas las cepas de C. coli (100%) estudiadas fueron clasificadas como moderadas formadoras de biopelículas, resultados que difirieron con Sualeman (2009), quienes detectaron solo un 12% de cepas de C. coli moderadas, 29% débiles, 58% no formadoras y ninguna fuertemente adherente. Si bien nuestro estudio mostró que todas las cepas de C. coli formaron biopelículas, se ha descripto que esa capacidad de formación es específica a cada cepa y por lo tanto no se puede predecir sólo conociendo la identidad de la especie (Gunther et al., 2009).
La capacidad de formación de biopelículas está fuertemente asociada con las condiciones ambientales desfavorables. Diversas investigaciones han demostrado que C. coli presenta capacidad para formar biopelículas sobre superficies abióticas o inertes, tales como vidrio, acero inoxidable, plástico y nitrocelulosa (Kalmokof, et al., 2006; Gunther et al., 2009). En este estudio observamos que las cuatro cepas de C. coli formaron biopelículas sobre vidrio, nailon y aluminio. La capacidad inhibitoria de biopelículas de BAL frente a una potencial adherencia de C. coli ha sido poco estudiada. Investigadores demostraron que la eficacia de las BAL para prevenir el crecimiento de CT, específicamente C. jejuni, se relaciona con la contaminación inicial del patógeno (Monteiro et al., 2021). Sin embargo, han sido desarrollados modelos para el uso de biopelículas de BAL en el control de otros patógenos involucrados en ETA tales como Listeria monocytogenes, Bacillus cereus, Escherichia coli, Salmonella ser. Typhimurium y Pseudomonas aeruginosa (Guerrieri et al., 2009; Gómez et al., 2016; Shokri et al., 2018). Las BAL tienen un gran potencial para su uso en la bio-preservación porque son seguras para el consumo y, durante el almacenamiento, dominan naturalmente la microbiota de muchos alimentos (Castellanos et al., 2008). En el presente estudio, el ensayo de exclusión competitiva de C. coli, a partir de la biopelícula formada por L. plantarum LP5, mostró resultados muy prometedores y este microorganismo podría ser incorporado como bio-protector de CT sobre la superficie de las carcasas. La bio-preservación es una tecnología relativamente reciente, basada en la incorporación de bacterias vivas a la superficie de la carne que antagonizan con las no deseadas (patógenas y/o alterantes), extendiendo su vida útil. Actualmente, esta tecnología ha sido efectiva para retardar el deterioro de la carne vacuna, pero existe escasa evidencia respecto a su aplicación en carne de pollo (Morales et al., 2020).
El crecimiento de L. plantarum LP5 sobre las superficies de vidrio, nailon y aluminio antes de incorporar cepas de C. coli, inhibe la formación de biopelículas de estas últimas mediante exclusión competitiva. Si bien es necesario realizar más pruebas para confirmar la capacidad de resistencia de C. coli y especies relacionadas de CT en ambientes hostiles hasta su llegada al huésped, este estudio permitiría avanzar en el esclarecimiento del comportamiento de estas cepas mediante la formación de biopelículas. No obstante, en vista que nuestros ensayos fueron realizados en condiciones óptimas de crecimiento para C. coli, los resultados obtenidos serán la base para diseñar nuevos estudios que propongan modificaciones en los parámetros intrínsecos y extrínsecos que puedan facilitar/inhibir el proceso de formación de biopelículas. La capacidad de supervivencia de CT a lo largo de la cadena productiva de aves de corral, debería alentar a los investigadores y a la industria a generar nuevas estrategias pre-faena para reducir la prevalencia y concentración de CT en el tracto digestivo de las aves y nuevos procesos de inactivación de biopelículas para disminuir su prevalencia.
Bibliografía
Cáceres ME, Etcheverría AI, Padola NL. 2019. Efectos del medio de cultivo y de la metodología aplicada sobre la formación de biopelículas de 2 cepas de Escherichia coli diarreagénicas. Rev. Argent. Microbiol. 51: 208-213.
Camargo AC, Woodward JJ, Call DR, Nero LA. 2017. Listeria monocytogenes in food-processing facilities, food contamination, and human listeriosis: the Brazilian scenario. Foodborne Pathog. Dis. 14: 623-636.
Castellano P, Belfiore C, Fadda S, Vignolo G. 2008. A review of bacteriocinogenic lactic acid bacteria used as bioprotective cultures in fresh meat produced in Argentina. Meat. Sci. 79: 483-499.
Gómez NC, Ramiro JM, Quecan BX, de Melo Franco BD. 2016. Use of potential probiotic lactic acid bacteria (LAB) biofilms for the control of Listeria monocytogenes, Salmonella Typhimurium, and Escherichia coli O157: H7 biofilms formation. Front. Microbiol. 7: 863.
Guerrieri E, de Niederhäusern S, Messi P, Sabia C, Iseppi R, Anacarso I, Bondi M. 2009. Use of lactic acid bacteria (LAB) biofilms for the control of Listeria monocytogenes in a small-scale model. Food Control. 20: 861-865.
Gunther IV NW, Chen CY. 2009. The biofilm forming potential of bacterial species in the genus Campylobacter. Food Microbiol. 26: 44-51.
Kalmokoff M, Lanthier P, Tremblay TL, Foss M, Lau PC, Sanders G, Szymanski CM. 2006. Proteomic analysis of Campylobacter jejuni 11168 biofilms reveals a role for the motility complex in biofilm formation. J. Bacteriol. 188: 4312-4320.
Monteiro GP, Rossi DA, Valadares EC, Peres PAB, Braz RF, Notário FO, Fonseca BB. 2021. Lactic bacterium and Bacillus sp. biofilms can decrease the viability of Salmonella gallinarum, Salmonella heidelberg, Campylobacter jejuni and methicillin resistant Staphylococcus aureus on different substrates. Rev. Bras. Cienc. Avic. 23: 1-12.
Morales P, Aguirre J, Troncoso M, Figueroa G. 2020. Comparison of in vitro and in situ antagonism assays as tools for the selection of bio-preservative lactic acid bacteria (LAB) in poultry meat. LWT. 118: 108846.
Reeser RJ, Medler RT, Billington SJ, Jost BH, Joens LA. 2007. Characterization of Campylobacter jejuni biofilms under defined growth conditions. Appl. Environ. Microbiol. 73: 1908-1913.
Rossler E, Fuhr EM, Lorenzón G, Romero-Scharpen A, Berisvil AP, Blajman JE, Astesana DM, Zimmermann JA, Fusari ML, Signorini ML, Soto LP, Frizzo LS, Zbrun MV. 2017. Presencia de serotipos de Campylobacter jejuni O:19 en la cadena avícola Argentina. Rev. Argent. Microbiol. 49: 178-182.
Ruiz MJ. 2019. Aislamiento e identificación de bacterias ácido lácticas con actividad inhibitoria de bacterias implicadas en enfermedades transmitidas por alimentos. Tesis doctoral, FCV-UNICEN. 124 pp.
Ruiz MJ, Zbrun MV, Signorini ML, Zimmermann JA, Soto LP, Rosmini MR, Frizzo LS. 2021. In vitro screening and in vivo colonization pilot model of Lactobacillus plantarum LP5 and Campylobacter coli DSPV 458 in mice. Arch. Microbiol. 1-11.
Shokri D, Khorasgani MR, Mohkam M, Fatemi SM, Ghasemi Y, Taheri-Kafrani A. 2018. The inhibition effect of lactobacilli against growth and biofilm formation of Pseudomonas aeruginosa. Probiotics Antimicrob. Proteins. 10: 34-42.
Sulaeman S, Le Bihan G, Rossero A, Federighi M, De E, Tresse O. 2010. Comparison between the biofilm initiation of Campylobacter jejuni and Campylobacter coli strains to an inert surface using BioFilm Ring Test®. J. Appl. Microbiol. 108: 1303-1312.
Zbrun MV, Rossler E, Romero-Scharpen A, Soto LP, Berisvil A, Zimmermann JA, Fusari M, Signorini ML, Frizzo LS. 2020. Worldwide meta-analysis of the prevalence of Campylobacter in animal food products. Res. Vet. Sci. 132: 69-77.
Información adicional
Este estudio fue financiado por CONICET (Proyecto PUE 058), Agencia Nacional de Promoción Científica y Tecnológica (Proyecto PICT 2016-3495) y Universidad Nacional del Litoral (Proyectos CAI+D 2020 50620190100062LI, 50620190100152LI y CAI+D Orientado 2016 2-14).: -