Artículos originales
Primer registro de nematodos zoonóticos de transmisión alimentaria (Nematoda: Anisakidae) en músculo de Cynoscion guatucupa (pescadilla de calada) y Macrodon ancylodon (pescadilla de red) comercializado en Uruguay
First record of foodborne zoonotic nematodes (Nematoda: Anisakidae) in muscle of fish marketed in Uruguay
Primer registro de nematodos zoonóticos de transmisión alimentaria (Nematoda: Anisakidae) en músculo de Cynoscion guatucupa (pescadilla de calada) y Macrodon ancylodon (pescadilla de red) comercializado en Uruguay
FAVE Sección Ciencias Veterinarias, vol. 21, e0009, 2022
Universidad Nacional del Litoral

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.
Recepción: 30 Noviembre 2021
Aprobación: 01 Junio 2022
Resumen: En los últimos 4 años, Uruguay ha experimentado una creciente demanda por el consumo de alimentos a base de pescado crudo, tales como sushi, sashimi y ceviche. Este escenario generó la necesidad de evaluar la presencia y concentración de parásitos zoonóticos (Nematoda: Anisakidae) en porciones comestibles de especies de pescado comercializadas en el mercado local. Se analizaron 233 ejemplares de tres especies de pescado comercializadas en Uruguay: Macrodon ancylodon, Micropogonias furnieri y Cynoscion guatucupa. Se cuantificaron e identificaron, a nivel de género, nematodos en cavidad celómica y músculo, estableciendo finalmente los descriptores ecológicos para cada género encontrado y para cada especie de pescado evaluada. Dos de las especies evaluadas se encontraban parasitadas a nivel de cavidad celómica y tejido muscular, M. ancylodon y C. guatucupa. Cynoscion guatucupa resultó la especie mayormente parasitada con una prevalencia de 46%, mientras que el género de anisákido más prevalente fue Contracaecum (prevalencia de 35,1% en C. guatucupa y 32,4% en M. ancylodon). El hallazgo de anisákidos en la especie M. ancylodon representa un nuevo registro de hospedador en Uruguay. Por otra parte, se reporta por primera vez en el país la presencia de estos parásitos zoonóticos en porciones comestibles (músculo).
Palabras clave: Anisákidos, diagnóstico, Cynoscion guatucupa. Macrodon ancylodon, músculo, Salud Pública, Uruguay.
Abstract: In the last 4 years, Uruguay has experienced a growing demand of raw fish-based foods, such as sushi, sahimi and ceviche. This scenario generated the need to assess the presence and concentration of zoonotic parasites (Nematodoes: Anisakidae) in edible parts of fish species traded in the local market. 233 fish specimens of 3 species commercialized in Uruguay were analyzed: Macrodon ancylodon, Micropogonias furnieri and Cynoscion guatucupa. The nematodes were quantified and identified at genus level, from coelomic cavity and muscle of the fishes, to finally stablish the ecological descriptors for each genus founded and for each fish species evaluated. Two of the three species of fish were parasitized with anisakids in both location (coelomic cavity and muscle), M. ancylodon and C. guatucupa. C. guatucupa was the most parasitized with a prevalence of 46%, while, the anisakid genus most prevalente was Contracaecum (prevalence of 35,1% in C. guatucupa and 32,4% in M. ancylodon). The finding of anisakids in M. ancylodon represents a report of a new host in Uruguay. Moreover, the finding for the first time in the country of these zoonotic parasites in edible parts of fish (muscle) is highlighted.
Keywords: Anisakids, diagnosis, Cynoscion guatucupa. Macrodon ancylodon, muscle, Public health, Uruguay.
Introducción
Los nematodos de la familia Anisakidae, fundamentalmente los géneros Anisakis, Pseudoterranova y Contracaecum, son reconocidos como agentes etiológicos de la ictiozoonosis parasitaria denominada Anisakiasis o Anisakidosis, enfermedad de transmisión alimentaria relacionada al consumo de productos pesqueros sin cocción. En cuanto a las especies de mayor relevancia para la salud pública, dada su frecuencia de identificación en casos de Anisakidosis humana, se destacan en primer lugar aquellas pertenecientes al complejo Anisakis simplex y en segundo lugar al complejo Pseudoterranova decipiens (Timi et al., 2014). Expertos de la Autoridad Europea en Inocuidad Alimentaria (EFSA, 2010), la definen como una enfermedad de importancia mundial, con aproximadamente 20.000 casos notificados desde 1960. La enfermedad en humanos se da por la ingestión de sus formas infectantes (larvas de tercer estadio) o por reacciones alérgicas contra sus antígenos. La incidencia se vincula estrechamente con la cultura gastronómica, es así que, Japón resulta ser el país mayormente afectado en el mundo, dada su hábito de consumo de preparaciones a base de pescado crudo, como sushi y sashimi (EFSA, 2010). En Europa, se ha mencionado a España con su consumo de anchoíta marinada (Bao et al., 2017) y a nivel regional, Chile y Perú, dado su consumo de ceviche (Eiras et al., 2018).
Los anisákidos son parásitos que tienen un ciclo biológico indirecto que se desarrolla en el medio acuático, con una amplia distribución mundial, teniendo como hospedadores definitivos a mamíferos y aves marinas (George-Nascimento y Urrutia, 2000; Irigoitia et al., 2021; Mattiucci et al., 2003; Nadler et al., 2005). El tercer estadio larvario (L3), forma infectante para los hospedadores definitivos, entre ellos el humano, se encuentra naturalmente en vísceras de diferentes especies de peces y cefalópodos como hospedadores paraténicos, estimando que a nivel mundial son más de 200 las especies de peces y 25 de cefalópodos donde se ha detectado la presencia de L3 de anisákidos (Abollo et al., 2001). El riesgo en la salud pública está dado por la presencia de estos nematodos en el músculo de pescado, porción comestible, ya que luego de la muerte de los ejemplares se da un fenómeno de migración de los parásitos desde vísceras hacia el músculo. Dicha migración se relaciona en forma directa con factores como la evisceración post-captura (Cipriani et al., 2016; Smith y Wootten, 1975) y la temperatura durante la refrigeración (Cipriani et al., 2016).
Estudios realizados en la región (Eiras et al., 2016; Galeano, 2017; Irigoitia et al., 2018; 2021; Timi et al., 2001; 2014) han identificado como potenciales fuentes de exposición especies de peces que también están presentes en aguas uruguayas y que son de interés comercial para el mercado local y para la exportación. En Brasil, Eiras et al. (2016) mencionan como hospedadores de L3 a las especies Micropogonias furnieri, Thunnus thynnus, Pomatomus saltatrix, Pargus pargus, Parona signata, Genypterus blacodes y Paralichthys isósceles, mientras que Di Azevedo & Iñiguez (2018), detectaron larvas del género Anisakis en M. furnieri y del género Hysterothylacium en M. furnieri, Genypterus brasilensis, y Mullus argentinae. En Argentina, se detectaron estos nematodos en ejemplares de Atlantoraja castelnaui (Irigoitia et al., 2018), Odontesthes bonariensis, Odontesthes argentinensis, Cynoscion guatucupa y Engraulis anchoíta, capturados en la Zona Común de Pesca argentino-uruguaya (Galeano, 2017; Timi et al., 2001). En referencia a las especies de anisákidos presentes en la región, se destaca la identificación en Argentina de Anisakis pegreffii y Anisakis berlandi (Irigoitia et al., 2018; 2021), Contracaecum osculatum (Galeano, 2017) y Pseudoterranova cattani (Irigoitia et al., 2018; Timi et al., 2014).
En Uruguay, la forma adulta de anisákidos se ha encontrado en ejemplares de franciscana (Pontoporia blainvillei) (Danilewicz et al., 2002) y lobo marino (Arctocephalus australis) (Katz et al., 2012). En referencia a recursos pesqueros de origen marino, estuarino y dulceacuícola destinadas al consumo humano, se destaca que los géneros Anisakis, Pseudoterranova y Contracaecum se han identificado en vísceras de calamar (Ilex argentinus) y de peces como Merluccius hubbsi, Cynoscion guatucupa, (Botto et al., 1976; Friss de Kereki, 2009), y específicamente el género Contracaecum se encontró en Hoplias malabaricus (Delgado et al., 2003) y en Odontesthes argentinensis (Vettorazzi, 2016).
A pesar de estos importantes hallazgos en Uruguay (Botto et al., 1976; Delgado et al., 2003; Friss de Kereki, 2009; Vettorazzi, 2016), en el país no se ha detectado la presencia de estos nematodos de transmisión alimentaria en la musculatura de pescado como porción comestible. Sumado a esto, Uruguay, más concretamente Montevideo, ha sido testigo de un fenómeno de carácter mundial, dado por el aumento del consumo de preparaciones a base de pescado crudo. En una encuesta preliminar, entre el 2017 y el 2020, el departamento de Montevideo pasó de tener 12 a 47 locales de elaboración y venta de platos a base de pescado crudo (sushi, sashimi, ceviche) (datos sin publicar). A partir de los resultados de dicha encuesta, se seleccionaron para el presente estudio tres de las especies nacionales mayormente utilizadas para la elaboración de estos alimentos.
Esta variación del perfil de consumo de pescado motiva el objetivo del presente trabajo en cuanto a la necesidad de conocer la probabilidad de ocurrencia y nivel de infestación de anisákidos en el tejido muscular, teniendo como hipótesis que las características de manejo del pescado fresco en la cadena de comercialización de Uruguay permiten la migración de larvas hacia el músculo.
Materiales y métodos
Muestreo
Para este estudio se analizaron en total 233 ejemplares de tres especies de pescado con interés comercial (Tabla 1), Micropogonias furnieri (Corvina rubia, n=94), Macrodon ancylodon (Pescadilla de red, n=102) y Cynoscion guatucupa (Pescadilla de calada, n=37). Los ejemplares fueron capturados en aguas del Río de la Plata y Océano Atlántico (frente a Punta del Este, Maldonado), por buques pesqueros nacionales, del tipo industrial y artesanal, que operaron durante los meses de febrero y agosto de 2021.
| Especie | n | Longitud (cm) | Peso (g) |
| Macrodon ancylodon | 102 | 29,9±3,6 | 248,1±95,7 |
| Cynoscion guatucupa | 37 | 44,4±4,1 | 808,2±165,1 |
| Micropogonias furnieri | 94 | 40,4±3,6 | 723,8±189,3 |
La totalidad de la muestra refiere a pescado entero (con vísceras), mantenido en refrigeración (0-5°C) desde su captura y hasta su procesamiento. El procesamiento y análisis del pescado para el diagnóstico de parásitos se realizó en la planta piloto y en el laboratorio de análisis de la Unidad de Ciencia y Tecnología de Productos Pesqueros (Facultad de Veterinaria, UdelaR. Montevideo, Uruguay). Cada ejemplar fue identificado en forma individual con la siguiente información: tipo de embarcación/zona de pesca/puerto o zona de desembarque/especie/longitud total/peso/fecha de procesado.
Identificación de nematodos en cavidad celómica de pescado
A cada ejemplar se le realizó una apertura de la cavidad abdominal para efectuar una inspección visual simple y detección de larvas de nematodos en vísceras y cavidad celómica. Los nematodos encontrados fueron retirados, lavados con agua destilada y colocados en tubos de ensayo debidamente identificados (uno por ejemplar) conteniendo alcohol 70% y se mantuvieron en refrigeración (5°C) hasta su posterior identificación de género. Se llevó un registro de la cantidad de nematodos cuantificados por individuo evaluado.
Identificación de nematodos en tejido muscular de pescado
Para esta etapa del estudio se desarrollaron y estandarizaron tres técnicas reconocidas internacionalmente por los Laboratorios de Referencia de la Unión Europea para Parásitos (EURLP – siglas en inglés): transiluminación simple (“Candling”); transiluminación por UV y digestión enzimática en medio ácido.
Luego de la inspección de vísceras, se realizaron cortes en los ejemplares para obtener filetes sin piel. En esta etapa se realizó una inspección visual simple de los filetes, mediante luz natural y artificial, para detectar presencia de nematodos en músculo. Posteriormente, los filetes se pesaron y se colocaron en bolsas, conservando el código original del ejemplar se envasaron al vacío, se aplanaron hasta obtener un espesor de filete de entre 1 y 2mm. Cada unidad envasada al vacío se congeló a -20°C, proceso recomendado para favorecer la fluorescencia y visualización de anisákidos por transiluminación UV. Entre ejemplar y ejemplar se realizó un lavado cuidadoso de las superficies de trabajo y utensilios para evitar la transferencia de parásitos entre individuos.
Se realizó la detección, cuantificación y registro de nematodos en filetes de cada ejemplar evaluado mediante transiluminación simple (“Candling”), utilizando mesas iluminadas (parasitoscopio) y mediante transiluminación UV, utilizando una lámpara UV (longitud de onda entre 250 y 360nm) con cabina, marca LABOTECGROUP.COM, modelo 203B (China).
Para el diagnóstico por digestión enzimática se siguieron los lineamientos definidos por EURLP y por los estándares de China para el procesamiento de productos acuáticos GAIN Report Number CH16010 (USDA Foreign Agriculture Service, 2016). Se preparó un jugo digestivo artificial disolviendo 5g de pepsina en 900ml de agua destilada, más el agregado de 7 ml de ácido clorhídrico (HCl) concentrado (pH=1,5) y finalmente un enrazado a 1000ml con agua destilada. El preparado se mezcló enérgicamente y se dejó reposar por 15 minutos previo a enfrentarlo a la muestra de músculo de pescado. Se realizó la apertura de las bolsas conteniendo la muestra de músculo y se vertió el jugo digestivo, con una proporción músculo/jugo de 1:10 (1000ml de jugo por cada 100gr de músculo), para luego realizar un homogeneizado suave, de forma manual, por 5 minutos. Se incubaron los preparados a 37°C hasta obtener una digestión completa del músculo (6-9 horas). Finalmente, se pasó el producto de la digestión por un tamiz, con un ancho de malla (0,25-0,75mm), a fin de retener y recuperar los nematodos presentes en cada muestra, los que fueron colocados en tubos de ensayo (debidamente identificados) conteniendo alcohol 70% y mantenidos en refrigeración (5°C) hasta su posterior identificación de género. La técnica de digestión enzimática en medio ácido se realizó en los ejemplares parasitados (conteniendo al menos un parásito en cavidad celómica o músculo).
Identificación de géneros de anisákidos
La totalidad de los nematodos encontradas en cavidad celómica y músculo fueron procesados para confirmar la presencia de anisákidos e identificar el género correspondiente siguiendo los lineamientos de autores internacionales (Cordero del Campillo & Rojo, 1999; Di Azevedo & Iñiguez, 2018; Measures, 2014; Shamsi et al., 2016)
Para la técnica, en una primera etapa, se colocaron los nematodos en una placa Petri para su visualización con lupa binocular, a modo de definir extremo anterior y posterior. La sección posterior de cada parásito se retiró mediante un corte con tijera en la zona media, se colocó en tubo eppendorf conteniendo alcohol 90% y se almacenó a -20°C, para realizar futuras identificaciones de especie mediante técnicas moleculares. Por su parte, la sección anterior (conteniendo las estructuras digestivas) se lavó con agua destilada y se sumergió durante 10-15 minutos en lactofenol con la finalidad de aclarar el nematodo y hacer visible sus estructuras internas. Las características morfológicas de cada género fueron evaluadas mediante el uso de un microscopio Olympus BX50, con programa “Micrometrics SE Premium” incorporado.
Cálculo de descriptores ecológicos
Para cada género de anisákido encontrado, y para cada especie de pescado parasitada, se calcularon los descriptores ecológicos definidos por Margolis et al. (1982) y Bush et al. (1997), prevalencia, abundancia media e intensidad media.
Análisis estadísticos
En las especies de pescado parasitadas se compararon las prevalencias mediante el test de Chi-Cuadrado, y la concentración de parásitos (intensidad media) mediante la prueba no paramétrica de Kruskal Wallis. Finalmente, se realizó un test de Regresión Lineal a fin de valorar el nivel de asociación entre la cantidad de parásitos presentes y el tamaño (longitud total) de los ejemplares, parámetro que se toma como referencia para la longevidad de los individuos.
Resultados
Un total de 575 larvas de anisákidos, considerando cavidad celómica (562 larvas) y tejido muscular (13 larvas), fueron recuperadas de dos de las especies de pescado evaluadas, C. guatucupa y M. ancylodon, con un rango de máximo y mínimo de 1 a 149 larvas y 1 a 72 larvas, respectivamente. En la Figura 1 se muestran imágenes de nematodos detectados en cavidad celómica de ejemplares de ambas especies. En cuanto a la especie M. furnieri, en ninguno de los 94 ejemplares evaluados se evidenciaron parásitos con ninguna de las técnicas de diagnóstico utilizadas.
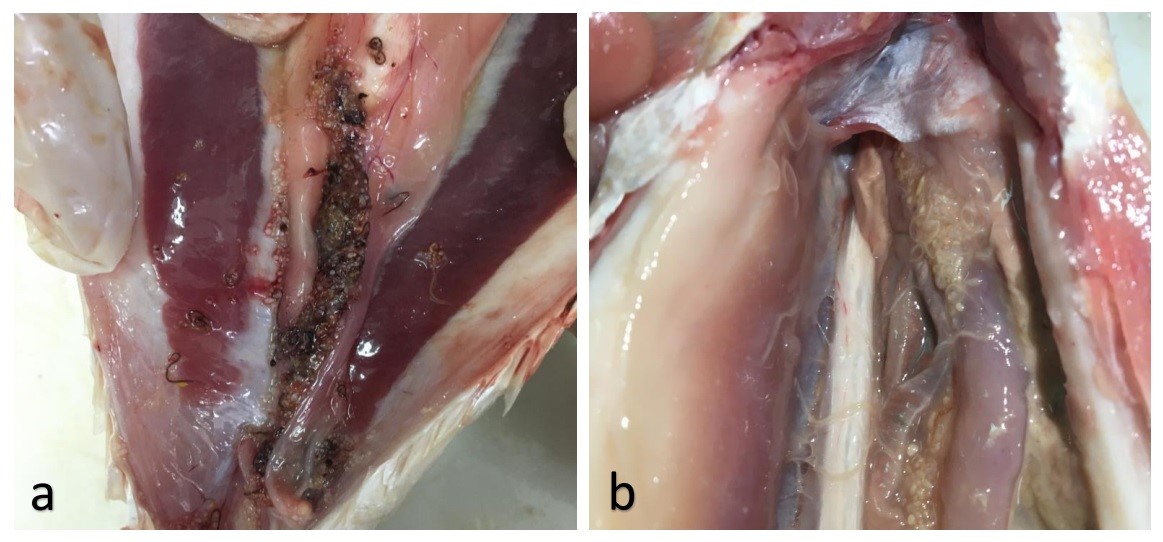
Figura 1
Detección de nematodos en cavidad celómica de C. guatucupa y M. ancylodon capturados por buques pesqueros de Uruguay. a. nematodos identificados en cavidad celómica de un ejemplar de C. guatucupa (total de larvas=149); b. nematodos identificados en cavidad celómica de un ejemplar de M. ancylodon (total de larvas=72).
La especie mayormente parasitada fue C. guatucupa (Tabla 2), donde 17 ejemplares (n=37) presentaron al menos un parásito en alguna de las dos localizaciones evaluadas (cavidad celómica y/o musculatura), equivalente a una prevalencia de 46%, en comparación con M. ancylodon, sobre la cual se identificaron 38 ejemplares parasitados de un total de 102 evaluados, prevalencia de 37,3%. Sin embargo, no se observaron diferencias estadísticamente significativas entre estas dos especies parasitadas en cuanto a la prevalencia.
| P (%) | AM | IM | ||||||||
| Hospedador | Larvas recuperadas | Localización | cc | mu | cc | mu | cc | mu | ||
| M. ancylodon | 248 | cc (246); mu (2) | 37,3 | 2 | 2,41 | 0,02 | 6,47 | 1 | ||
| C. guatucupa | 327 | cc (316); mu (11) | 43,2 | 8,1 | 8,54 | 0,3 | 19,75 | 3,67 | ||
| M. furnieri | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| Total | 575 | |||||||||
Respecto del tejido muscular, 3 ejemplares de la especie C. guatucupa y 2 M. ancylodon se encontraban parasitados. Todos estos ejemplares también evidenciaron larvas en cavidad celómica, excepto uno de la especie C. guatucupa que se encontraba parasitado únicamente a nivel muscular, el cual resultó ser a su vez el ejemplar con mayor nivel de infestación en músculo, con 8 larvas registradas. Si bien se aprecia que C. guatucupa registró los mayores índices de infestación (abundancia e intensidad media), tanto en cavidad celómica como en músculo (Tabla 2), se realizó un test de Kruskal Wallis para determinar si la cantidad de anisákidos difería entre especies parasitadas M. ancylodon (n=102) y C. guatucupa (n=37), no detectando diferencias significativas: X.(1) = 1.747, .=0,187. En la Figura 2 se muestran imágenes de larvas de anisákidos detectadas en músculo por dos técnicas de diagnóstico (Candling y Transiluminación UV).
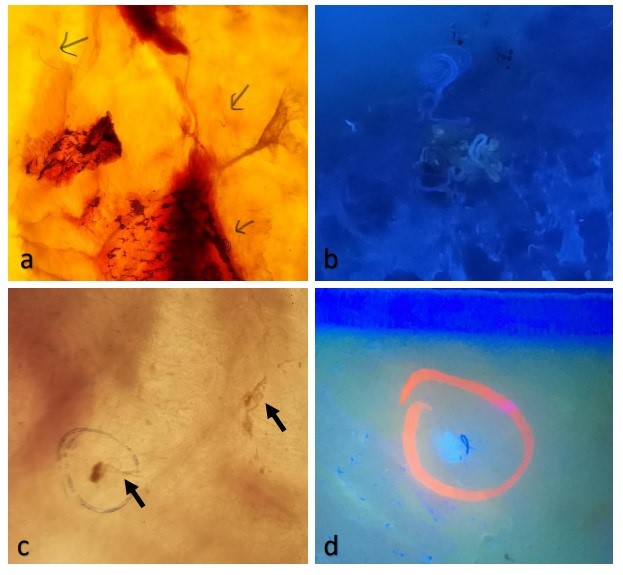
Figura 2.
Detección de larvas de anisákidos en tejido muscular de ejemplares de C. guatucupa y M. ancylodon capturados por buques pesqueros de Uruguay. a y b. Anisákidos detectados en tejido muscular de un ejemplar de C. guatucupa por el método de transiluminación simple o “candling” (a) y por método de transiluminación UV (b) (total de larvas=8) / c. Anisákidos detectados en tejido muscular de un ejemplar de C. guatucupa por el método de transiluminación simple o “candling” (total de larvas=2) / d. Anisakido detectado en tejido muscular de un ejemplar de M. ancylodon por el método de transiluminación UV (total de larvas=1).
En referencia a la asociación estudiada mediante el test de regresión lineal entre el tamaño de los ejemplares (longitud total) y la cantidad de parásitos presentes, si bien se observó que ejemplares de mayor tamaño presentaban un mayor nivel de infestación, no se detectó asociación significativa entre estas variables para la especie M. ancylodon (n=102, R.=0,035, .=0,061), ni para C. guatucupa (n=37, R.=0,024, .=0,365).
De los 575 anisákidos detectados y procesados para la identificación de género, 94 (16,3%) se encontraban con un grado de deterioro que no permitió la correcta visualización de las estructuras digestivas, siendo desestimados para el cálculo de los descriptores ecológicos.
Se identificaron tres géneros de anisákidos (Contracaecum, Pseudoterranova . Anisakis), en ambas especies de pescado parasitadas. El género más prevalente y con mayor intensidad de infestación fue Contracaecum (Figura 3). Específicamente para este género de anisákido, en C. guatucupa se registró una prevalencia (P)=35,1% y una intensidad media (IM)=10,85, mientras que en M. ancyodon los índices registrados fueron P=32,4%; IM=4,67 (Tabla 3).
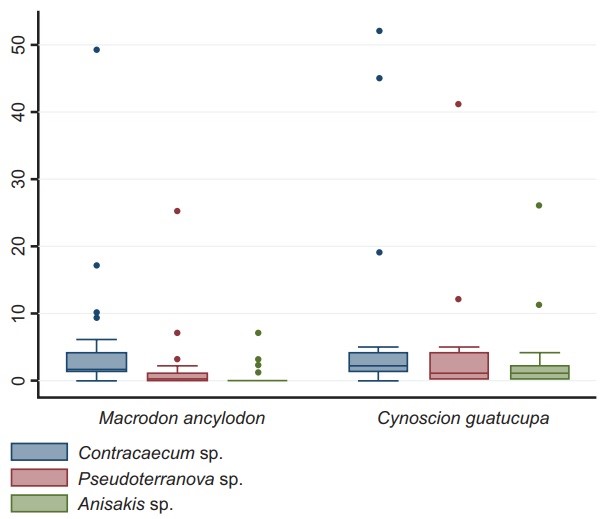
Figura 3.
Representatividad de los géneros de anisákidos identificados en los ejemplares parasitados de C. guatucupa y M. ancylodon mediante visualización de estructuras digestivas al microscopio (N=481 larvas).
| Hospedador | n | Género | P (%) | AM | IM |
| Macrodon ancylodon | 102 | Contracaecum sp. | 32,4 | 1,51 | 4,67 |
| Pseudoterranova sp. | 11,8 | 0,45 | 3,83 | ||
| Anisakis sp. | 7,8 | 0,17 | 2,13 | ||
| Cynoscion guatucupa | 37 | Contracaecum sp. | 35,1 | 3,81 | 10,85 |
| Pseudoterranova sp. | 27 | 1,95 | 7,2 | ||
| Anisakis sp. | 27 | 1,38 | 5,1 |
A nivel del tejido muscular, en la especie C. guatucupa se constataron 4 Pseudoterranova sp., 3 Anisakis sp. y 1 Contracaecum sp., mientras que en ejemplares de M. ancyodon se identificaron 2 Contracaecumsp. y 1 Pseudoterranova sp. En la Figura 4 se detallan las diferencias morfológicas del aparato digestivo visualizadas al microscopio para cada género de anisákido.

Figura 4.
Diferenciación morfológica de los géneros de anisákidos identificados en las especies C. guatucupa y M. ancylodon, por la técnica de aclaración con lactofenol y visualización al microscopio. a. Género Contracaecum recuperado de cavidad celómica de M. ancylodon: esófago (a1), ventrículo (a2), apéndice ventricular (a3), ciego intestinal (a4) / b. Género Pseudoterranova recuperado de músculo de C. guatucupa: esófago (b1), ventrículo (b2), ciego intestinal (b3) / c. Género Anisakis recuperado de músculo de C. guatucupa: esófago (c1), ventrículo (c2), intestino (c3).
Discusión
Son numerosos los trabajos científicos dirigidos a detectar la presencia y distribución de estos parásitos zoonóticos en aguas del suroeste atlántico, así como la prevalencia y nivel de infestación de diferentes especies de pescados, óseos y cartilaginosos, que son de interés comercial. Los estudios realizados en Argentina revisten particular interés dado que es un país que comparte con Uruguay zonas de captura y aprovechamiento de los recursos pesqueros. Incluso en algunos trabajos, parte de las muestras de pescado obtenidas provenían de la zona común de pesca argentino-uruguaya, lo cual hace que los reportes de especies hospedadoras puedan ser consideradas como un diagnóstico de situación de los recursos pesqueros capturados por buques uruguayos. Dentro de estos reportes, se puede mencionar que los géneros de anisákidos identificados en el presente trabajo han sido diagnosticados en especies de peces óseos como Engraulis anchoita (anchoita), Trichiurus lepturus (pez sable), Percophis brasiliensis (pez palo), Pagrus pagrus (pargo rosado), Acanthistius patachonicus (mero de la Patagonia), Pseudopercis semifasciata (salmón de mar); Odontesthes bonariensis (pejerrey), Prionotus nudigula (tostelin rojo), Genypterus blacodes (abadejo), Merluccius hubbsi (merluza argentina), Patagonotothen ramsayi (nototenia), Scomber japonicus (caballa) y Paralichthys isoseles (lenguado) (Braicovich y Timi, 2008; Hernández-Orts et al., 2013; Mancini et al., 2014; Soares et al., 2018; Timi et al., 2001; 2014). Cabe destacar que estos autores no solo detectaron anisákidos a nivel de cavidad celómica sino también en el tejido muscular. En referencia a especies de peces cartilaginosos como hospedadores, se destacan dos reportes. Knoff et al. (2001), constataron la presencia de anisákidos en tiburones y rayas capturados en costas de Brasil y más recientemente, Irigoitia et al. (2018) identificaron las especies Anisakis berlandi, Anisakis pegreffi y Pseudoterranova cattani en vísceras de rayas (Sympterygia bonapartii, Zearaja chilensis y Atlantoraja castelnaui).
La presencia de larvas de anisákidos también se ha registrado en especies de aguas continentales. En Uruguay, el género Contracaecum fue reportado en Hoplias malabaricus (tararira) por Delgado et al. (2003). Más en la actualidad, dos estudios reportaron nuevas especies hospedadoras obtenidas de lagunas costeras del departamento de Rocha. Delgado y García (2015) identificaron estos nematodos en peces ornamentales de la familia Rivulidae, confirmando por técnicas moleculares la existencia de dos especies diferentes de Contracaecum (sp1 y sp2), mientras que Vettorazzi (2016) registró en la especie una prevalencia entre 5 y 21% y una intensidad media de infestación de 1,25 en Odontesthes argentinensis (pejerrey).
Micropogonias furnieri (corvina rubia) ha sido mencionada en la literatura científica como hospedador de anisákidos (Eiras et al., 2016; Falla-Zuñiga et al., 2021). Sardella et al. (1995), enfocaron su trabajo en la presencia de estos nematodos zoonóticos en la cavidad celómica, mesenterio y vísceras de esta especie bentónica y costera, registrando una prevalencia de 0,4% para el género Anisakis. En Brasil, Di Azevedo & Iñiguez (2018), también identificaron esta especie como hospedadora de los géneros Anisakis e Hysterothylacium, registrando índices de prevalencia/intensidad media/abundancia media de 1,7% /1,0 / 0,017 y 3,3% / 1,0 / 0,03 respectivamente para los dos géneros mencionados. Únicamente para el caso del Hysterothylacium, los autores detectaron la presencia de larvas en el tejido muscular. Sin embargo, en el presente estudio no se constató la presencia de anisákidos en ninguno de los ejemplares analizados (n=94).
En referencia al hallazgo de larvas de anisákidos en la especie Macrodon ancyodon (pescadilla de red), se identifica como un nuevo hospedador en Uruguay, dada la ausencia de trabajos científicos en el país que señalen esta especie como susceptible. A nivel regional, en Brasil, Sabas y Luque (2003), Fujimuto et al. (2012) y Eiras et al. (2016), identificaron a esta especie como hospedadora de anisákidos, alojados en vísceras o cavidad celómica, pero a diferencia del presente estudio, no evaluaron la presencia de larvas a nivel muscular.
La especie Cynoscion guatucupa (pescadilla de calada), que resultó ser la especie con mayor prevalencia y cantidad de parásitos en el presente trabajo, ha sido estudiada por diferentes autores nacionales. Botto et al. (1976), realizaron una evaluación que incluyó la pescadilla de calada como objetivo, anteriormente denominada Cynoscion striatus, así como otras especies de interés comercial como la merluza (Merluccius hubbsi), anchoíta (Engraulis sp.) y burriqueta (Menthicirrhus martinicensis). Los autores identificaron la presencia de larvas de anisákidos en vísceras de C. striatus . M. hubbsi, reportando prevalencias de 6,3% y 79,5%, respectivamente, índice sensiblemente menor al registrado en el presente trabajo para C. guatucupa. Timi et al. (2005), Fontenelle et al. (2013) y Galeano (2017), de igual forma, detectaron anisákidos en vísceras y cavidad abdominal de esta especie de pescado, capturado en costas uruguayas, argentinas y brasileras, destacando la presencia del género Hysterothylacium, el cual no se constató en el presente estudio.
Por su parte, Friss de Kereki (2009) y Delgado (2010), detectaron nuevamente la presencia de estos nematodos en muestras de C. guatucupa, con una prevalencia de 36%, intensidad y abundancia media de 9,4 y 3,3 respectivamente. Estos valores resultan inferiores a los índices reportados en el presente estudio, diferencia puede estar explicada por la época del año. El muestreo realizado por dichas autoras se llevó a cabo en los meses de abril y mayo (otoño), mientras que, en el presente estudio, la muestra se conformó en su mayoría por pescado capturado en verano (febrero), lo que podría sugerir que épocas del año con mayor temperatura favorecería la presencia de parásitos en el medio acuático y consecuentemente en los hospederos. Por otra parte, las autoras también identificaron los 3 géneros de anisákidos en C. guatucupa. Sin embargo, de forma contraria a los presentes hallazgos, constataron que el género menos prevalente fue Contracaecum (23% de las larvas identificadas), seguido por Anisakis 32% y Pseudoterranova como el género de mayor ocurrencia, representando el 45% de las larvas halladas e identificadas. En ninguno de los trabajos llevados a cabo en Uruguay, donde se evaluó la presencia y nivel de infestación con estos nematodos zoonóticos, se mencionó el tejido muscular (porción comestible de pescado) como sitio de localización de larvas, dado que la metodología de diagnóstico aplicada en esos estudios se limitó a la inspección visual simple de los filetes de pescado.
En tal sentido, y considerando el desarrollo e implementación de técnicas de diagnóstico más sensibles para la detección de nematodos en músculo, los hallazgos del presente estudio donde se mencionan las especies C. guatucupa y M. ancylodon como parasitadas a nivel muscular, se destaca como el primer reporte científico en Uruguay que demuestra la migración de larvas desde vísceras hacia la porción comestible de especies de pescado que son comercializadas en el país y destinadas a la exportación. Más destacable aún, ambas son especies de interés para preparaciones gastronómicas a base de pescado crudo, como sushi, sashimi y ceviche (datos sin publicar).
A nivel regional, en Brasil, Rodrigues et al. (2010), evaluaron ejemplares de Cynoscion sp. sobre un tamaño de muestra más elevado (n=92). Los autores no solo constataron la presencia de larvas de anisákidos en cavidad celómica, sino que al igual que en el presente trabajo, identificaron el parásito en el tejido muscular. Las prevalencias reportadas por estos autores fueron de 67,3%; 30,76% y 3,84 para los géneros Contracaecum, Anisakis . Pseusoterranova, respectivamente, coincidiendo con los resultados del presente estudio, donde se identifica al género Contracaecum como el más prevalente.
En referencia al factor talla de ejemplar, y su relación con la presencia y cantidad de parásitos presentes, los resultados del actual trabajo están en concordancia con lo reportado por Sardella et al. (1995), ya que, si bien no se constató una asociación estadísticamente significativa, los ejemplares de mayor tamaño presentaron una mayor frecuencia de infestación, incluso una mayor intensidad de infestación con parásitos. Botto et al. (1976), también evaluaron esta relación en M. hubbsi (merluza), aunque en este caso sí reportaron una significancia estadística en la asociación entre estas dos variables, resaltando que el grupo de ejemplares de mayor tamaño presentó una mayor prevalencia (33% en menores de 50cm vs 92,5% en ejemplares de 50cm o más), así como un mayor nivel de infestación. Dado que en peces la talla se toma como referencia para definir la edad del ejemplar, se podría pensar que los individuos de mayor edad tengan más probabilidad de estar parasitados que los juveniles, incluso con un mayor número de larvas por un posible efecto acumulativo.
La ratificación de la presencia de los tres géneros de anisákidos (Contracaecum. Anisakis . Pseuderranova), si bien aporta información sobre estos parásitos en aguas uruguayas y sus recursos hidrobiológicos, hace imperativo profundizar en estudios más enfocados a las especies de anisákidos mediante técnicas moleculares, así como investigar qué otros recursos pesqueros estarían involucrados en el ciclo biológico y podrían ser fuentes de estos agentes zoonóticos.
Se destaca la presencia de estos nematodos en la musculatura de ambas especies parasitadas (C. guatucupa y M. ancylodon), que comprueba la migración de larvas desde vísceras. Este hallazgo representa el primer reporte en el país de anisákidos con esta localización, lo que a su vez confirma la existencia de un riesgo real de contraer Anisakidosis en humanos, cuando estas especies de pescado se consumen sin un previo tratamiento de inactivación o destrucción.
Referencias
Abollo E, Gestal C, Pascual S. 2001. Anisakis infestation in marine fish and cephalopods from Galician waters: An updated perspective. Parasitol. Res. 87: 492-499.
Bush AO, Lafferty KD, Lotz JM, Shostak AW. 1997. Parasitology Meets Ecology on Its Own Terms: Margolis et al. Revisited. J. Parasitol. 83: 575-583.
Bao M, Pierce GJ, Pascual S, González-Munõz M, Mattiucci S, Mladineo I, Cipriani P, Bušelić I, Strachan NJC. 2017. Assessing the risk of an emerging zoonosis of worldwide concern: Anisakidosis. Sci. Rep. 7: 1-17.
Botto C, Osimani J, Mañé F. 1976. Sobre la presencia de larvas de Anisakis sp. en peces de la costa Atlántica Uruguaya y su patogenicidad experimental para el perro y el gato. Revta. Urug. Patol. Clin. Microbiol. 3: 49-62.
Braicovich PE, Timi JT. 2008. Parasites as biological tags for stock discrimination of the Brazilian flathead Percophis brasiliensis in the south-west Atlantic. J. Fish Biol. 73: 557-571.
Cipriani P, Acerra V, Bellisario B, Luca G, Cheleschi R, Nascetti G, Mattiucci S. 2016. Larval migration of the zoonotic parasite Anisakis pegreffii (Nematoda: Anisakidae) in European anchovy, Engraulis encrasicolus: Implications to seafood safety. Food Control 59: 148-157.
Cordero del Campillo M, Rojo F. 1999. Parasitología Veterinaria. 1ª Edición. Madrid. Mc Graw - Hill - Interamericana de España. 987 pp.
Danilewicz D, Rosar F, Bastida R, Marigo J, Muelbert M, Rodríguez D, Lailson Brito Jr J, Ruoppolo V, Ramos R, Bassoi M, Ott PH, Caon G, Monteiro da Rocha A, Catâo-Días JL, Secchi ER. 2002. Report of the working group on biology and ecology. Lat. Am. J. Aquat. Mamm. 1: 25-42.
Delgado, E., Fagerholm, H. P. & R. Ponce de León. 2003. Larvae of Contracaecum Railliet & Henry, 1912 (Nematoda, Anisakidae) in Hoplias malabaricus (Bloch, 1794) (Pisces, Erythrinidae) from Northeastern Uruguay. Actas VII Jornadas de Zoología del Uruguay, 13-17/10/2003, Facultad de Ciencias, Montevideo, Uruguay. 53 pp.
Delgado G. 2010. Determinación de larvas de anisákidos en Cynoscion guatucupa (Pescadilla) e Illex argentinus (Calamar). Tesis de Grado. Facultad de Veterinaria: Universidad de la República.
Delgado C, García G. 2015. Coevolution between Contracaecum (Nematoda, Anisakidae) and Austrolebias (Cyprinodontiformes, Rivulidae) host-parasite complex from SW Atlantic coastal basins. Parasitol. Res. 114: 913-927.
Di Azevedo MIN, Iñiguez AM. 2018. Nematode parasites of commercially important fish from the southeast coast of Brazil: Morphological and genetic insight. Int. J. Food Microbiol. 267: 29-41.
EFSA (European Food Safety Authority). 2010. Scientific Opinion on risk assessment of parasites in fishery products. EFSA J. 8: 1543.
Eiras JC, Pavanelli GC, Takemoto RM, Nawa Y. 2018. Fish-borne nematodiases in South America: Neglected emerging diseases. J. Helminthol. 92: 649-654.
Eiras JC, Pavanelli GC, Takemoto RM, Yamaguchi MU, Karkling LC, Nawa Y. 2016. Potential risk of fish-borne nematode infections in humans in Brazil – Current status based on a literature review. Food Waterborne Parasitol. 5: 1-6.
Falla-Zuñiga LF, Castellanos-Garzón JA, Salazar L, Pustovrh MC. 2021. Anisakis and anisákidosis: Hosts and case reports in South America. systematic review. Rev. Fac. Med. 69: 1-19.
Fontenelle G, Knoff M, Nunes Felizardo N, Silva Lopes LM, Carmona de São Clemente S. 2013. Nematodes of zoonotic importance in Cynoscion guatucupa (Pisces) in the state of Rio de Janeiro. Rev. Bras. Parasitol. 22: 281-284.
Friss de Kereki, C. 2009. Determinación de larvas de nematodes de la familia Anisakidae en pescadilla de calada (Cynoscion guatucupa) y en calamar (Illex argentinus), capturados en el Río de la Plata y en el Atlántico sudoccidental y comercializados en Uruguay. Tesis de Maestría. Facultad de Ciencias Veterinarias: Universidad de Buenos Aires. 37 pp.
Fujimoto RY, de Melo Braun Sarmento A, Daniel Guerreiro Diniz D, Costa Eiras J. 2012. Nematode Parasites of Pescada Gó, Macrodon ancylodon Bloch and Schneider, 1801 (Osteichthyes, Sciaenidae), from Vila dos Pescadores, Bragança-PA, Brazil. Braz. Arch. Biol. Technol. 55: 865-870.
Galeano NA. 2017. Evaluación del potencial zoonótico de Contracaecum spp. (Nematoda:Anisakidae) e Hysterothylacium spp. (Nematoda: Raphidascarididae) como agentes de anisákidosis humana. PhD Thesis. Universidad Nacional del Sur. Bahia Blanca, Argentina. George-Nascimento M, Urrutia X. 2000. Pseudoterranova cattani sp. nov. (Ascaridoidea: Anisakidae), a parasite of the South American sea lion Otaria byronia De Blainville from Chile. Rev. Chil. de Hist. Nat. 73: 93-98.
Hernández-Orts JS, Aznar FJ, Blasco-Costa I, García NA, Víllora-Montero M, Crespo EA, Raga JA, Montero FE. 2013. Description, microhabitat selection and infection patterns of sealworm larvae (Pseudoterranova decipiens species complex, nematoda: Ascaridoidea) in fishes from Patagonia, Argentina. Parasit. Vectors 6: 252.
Irigoitia MM, Braicovich PE, Lanfranchi AL, Farber MD, Timi JT. 2018. Distribution of anisakid nematodes parasitizing rajiform skates under commercial exploitation in the Southwestern Atlantic. Int. J. Food Microbiol. 267: 20-28.
Irigoitia MM, Palomba M, Braicovich PE, Lanfranchi AL, Denuncio PE, Gana JCM, Mattiucci S, Timi JT. 2021. Genetic identification of Anisakis spp. (Nematoda: Anisakidae) from cetaceans of the Southwestern Atlantic Ocean: ecological and zoogeographical implications. Parasitol. Res. 120: 1699-1711.
Katz H, Morgades D, Castro-Ramos M. 2012. Pathological and Parasitological Findings in South American Fur Seal Pups (Arctocephalus australis) in Uruguay . ISRN Zoology. 1-7.
Knoff M, De São Clemente SC, Pinto RM, Gomes DC. 2001. Nematodes of Elasmobranch Fishes from the Southern Coast of Brazil. Mem. Inst. Oswaldo Cruz. 96: 81-87.
Mancini MA, Biolé FG, Salinas VH, Guagliardo SE, Tanzola RD, Morra G. 2014. Prevalencia, intensidad y aspectos ecológicos de Contracaecum sp. (Nematode: Anisakidae) en peces de agua dulce de Argentina. Neotrop. Helminthol. 8: 111-122.
Margolis L, Esch GW, Holmes JC. 1982. The use of ecological terms in parasitology (report of an ad hoc committee of the American society of parasitologists). J. Parasitol. 68: 131-133.
Mattiucci S, Cianchi R, Nascetti G, Paggi L, Sardella N, Timi J, Webb SC, Bastida R, Rodríguez D, Bullini L. 2003. Genetic evidence for two sibling species within Contracaecum ogmorhini Johnston & Mawson, 1941 (Nematoda: Anisakidae) from otariid seals of boreal and austral regions. Syst. Parasitol. 54: 13-23.
Measures LN. 2014. Anisakiosis and pseudoterranovosis: Reston, Va., U.S. Geological Survey Circular 1393. 34 pp.
Nadler SA, D’Amelio S, Dailey MD, Paggi L, Siu S, Sakanari JA. 2005. Molecular phylogenetics and diagnosis of Anisakis, Pseudoterranova, and Contracaecum from northern pacific marine mammals. J. Parasitol. 91: 1413-1429.
Rodrigues MV, Del Fava C, Pérez ACA. 2010. Determinação do parasita anisaquídeo em pescada (Cynoscion spp.) como ponto crítico de controle na cadeia produtiva do pescado comercializado na baixada santista. Rev. Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP. 9: 32-32.
Sabas CSS, Luque JL. 2003. Metazoan parasites of weakfish, Cynoscion guatucupa and Macrodon ancylodon (Osteichthyes: Sciaenidae), from the coastal zone of the state of Rio de Janeiro, Brazil. Rev. Bras. Parasitol. 12: 171-178.
Sardella NH, Etchegoin JA, Martorelli SR. 1995. Las comunidades parasitarias de Micropogonias furnieri (corvina) en Argentina. Boletín Del Instituto Oceanográfico de Venezuela 34: 41-47.
Shamsi S, Ghadam M, Suthar J, Ebrahimzadeh Mousavi H, Soltani M, Mirzargar S. 2016. Occurrence of ascaridoid nematodes in selected edible fish from the Persian Gulf and description of Hysterothylacium larval type XV and Hysterothylacium persicum n. sp. (Nematoda: Raphidascarididae). Int. J. Food Microbiol. 236: 65-73.
Smith JW, Wootten R. 1975. Experimental Anisakis sp. larvae (Nematoda: Ascaridida) into the flesh of herring, Clupea harengus. Int. J. Parasitol. 5: 133-136.
Soares IA, Lanfranchi AL, Luque JL, Haimovici M, Timi JT. 2018. Are different parasite guilds of Pagrus pagrus equally suitable sources of information on host zoogeography? Parasitol. Res. 117: 1865-1875.
Timi JT, Sardella NH, Navone GT. 2001. Parasitic nematodes of Engraulis anchoita Hubbs et Marini, 1935 (Pisces, Engraulidae) of the Argentine and Uruguayan coasts, South West Atlantic. Acta Parasitol. 46: 186-193.
Timi JT, Luque JL, Sardella NH. 2005. Parasites of Cynoscion guatucupa along South American Atlantic coasts: evidence for stock discrimination. J. Fish Biol. 67: 1603–1618.
Timi JT, Paoletti M, Cimmaruta R, Lanfranchi AL, Alarcos AJ, Garbin L, George-Nascimento M, Rodríguez DH, Giardino GV, Mattiucci S. 2014. Molecular identification, morphological characterization and new insights into the ecology of larval Pseudoterranova cattani in fishes from the Argentine coast with its differentiation from the Antarctic species, P. decipiens sp. E (Nematoda: Anisakidae). Vet. Parasitol. 199: 59-72.
USDA (United State Department of Agriculture) Foreign Agricultural Service. 2016. China Published Final Standard for Processed Aquatic Products of Animal Origin. GAIN Report Number CH16010. 7 pp.
Vettorazzi R. 2016. Estudio taxonómico de la parasitofauna de Odontesthes argentinensis Valenciennes, 1835) de las lagunas de Rocha y Garzón (Uruguay). Tesina de Grado. Facultad de Ciencias: Universidad de la República. 72 pp.
Información adicional
Agradecimientos: Un agradecimiento especial al Lic. Oscar Castro de la Facultad de Veterinaria (UdelaR) por su experiencia y conocimientos brindados para la identificación de los géneros de estos nematodos zoonóticos, y a Sr. Gonzalo Chalela por su colaboración en el desarrollo e implementación de las técnicas de laboratorio para la identificación de nematodos en músculo de pescado. Agradecemos también a la Unidad Académica de Patología, Biología y Cultivo de Organismos Acuáticos (PaBCOA) de la Facultad de Veterinaria (UdelaR), por su colaboración y por permitir el acceso al equipamiento necesario para la etapa de identificación de parásitos. Agradecer, a su vez, a las empresas que colaboraron con los investigadores para poder acceder a las muestras de pescado que fueron incluidas en el presente estudio.