Artículos originales
Evaluaciones sobre la eficacia clínica de la ivermectina en el control de los pequeños estróngilos equinos (Cyathostoma spp). Status de susceptibilidad o resistencia en establecimientos del área central de la Argentina
Clinical effectiveness assesment of ivermectin in equine small strongiles (Cyathostoma spp) control. Susceptibility or resistance status in farms in the central area of Argentina
Evaluaciones sobre la eficacia clínica de la ivermectina en el control de los pequeños estróngilos equinos (Cyathostoma spp). Status de susceptibilidad o resistencia en establecimientos del área central de la Argentina
FAVE Sección Ciencias Veterinarias, núm. 22, 2023
Universidad Nacional del Litoral
Recepción: 08 Agosto 2022
Aprobación: 20 Diciembre 2022
Resumen: Los pequeños estróngilos (o grupo Ciatostoma) comprenden a más de 50 especies y son los parásitos más comunes de los caballos adultos en todo el mundo. El control está basado en el uso masivo de antihelmínticos lo cual está permitiendo el desarrollo de fenómenos de resistencia. El Test de Reducción en el Conteo de Huevos (TRCH) es actualmente el método más utilizado para detectar la resistencia antihelmíntica, mientras que el Período de Reaparición de Huevos (PRH) puede actuar como un indicador temprano de la misma. Este estudio evaluó la actividad de lactonas macrocíclicas (ivermectina y moxidectina) en 192 equinos de 15 establecimientos del área central de la Argentina utilizando el TRCH y un modelo jerárquico bayesiano para el análisis de los datos. La misma metodología se utilizó sobre la semana 7 post tratamiento para detectar posibles acortamientos en el PRH. La eficacia general de ambas lactonas evaluada 14 días post tratamiento fue muy alta en todos los establecimientos (99,8%-100 %) y en uno sólo de estos se observó un acortamiento del PRH. Es necesario un uso más selectivo de estas drogas para preservar su vida útil y demorar el desarrollo de resistencia.
Palabras clave: equinos, pequeños estróngilos, resistencia, Argentina, ivermectina.
Abstract: The small strongyles (or Cyathostomins) comprise more than 50 species and are the most common parasites of adult horses worldwide. Control is based on the massive use of anthelmintics, which is allowing the development of resistance. The Fecal Egg Count Reduction Test (FECRT) is currently the most widely used method to detect anthelmintic resistance, while the Egg Reappearance Period (ERP) can act as an early indicator of resistance. This study evaluated the activity of macrocyclic lactones (ivermectin and moxidectin) in 192 horses from 15 farms in the central area of Argentina using the FECRT and a Bayesian hierarchical model for data analysis. The same methodology was used on week seven post treatment to detect possible shortening in the ERP. The general efficacy of macrocyclic lactones at 14 days post-treatment was very high in all farms (99,8%-100%) with just one of these showing a shortening of the ERP. A more selective use of these drugs in Argentina is necessary to preserve their useful life and maintain the sustainability of these chemical control alternatives.
Keywords: horses, small strongyles, ivermectin, resistance, Argentina.
Introducción
En nuestro país y al igual que en todo el mundo, la diversidad en las poblaciones de nematodos intestinales equinos adultos ha cambiado severamente en las últimas décadas con una mayoritaria presencia de los pequeños estróngilos o grupo ciatostoma y una baja prevalencia de los grandes estróngilos. Por otra parte, en la categoría potrillos, Parascaris spp permanece como el parásito de mayor importancia (Nielsen et al., 2014; Scott et al., 2015). Desde una perspectiva global, las drogas de amplio espectro que se utilizan para el control de estos nematodos pertenecen a tres grupos químicos, los bencimidazoles, las tetrahidropirimidinas y las lactonas macrocíclicas, pero la resistencia antihelmíntica (RA) está comprometiendo la sustentabilidad del control químico. En la Argentina al igual que en la mayor parte del mundo, la RA de los pequeños estróngilos a los bencimidazoles es actualmente muy común (Anziani et al., 2005; Anziani et al., 2016; Cerutti et al., 2012) y parece ser más la regla que la excepción. Así el uso de este grupo químico en equinos adultos para controlar pequeños estróngilos debería ser desaconsejada a menos que se realicen controles post tratamiento para establecer la eficacia de los mismos. Por el contrario, los bencimidazoles continúan como la droga de elección contra Parascaris spp por su amplio margen de seguridad y elevada eficacia (Anziani et al., 2017). Las lactonas macrocíclicas y especialmente la ivermectina son las drogas más utilizadas en el control parasitario de los equinos en todo el mundo (Molento et al., 2012; Nielsen et al., 2018; Sallé et al., 2015; Wilkes et al., 2020). En nuestro país, por ejemplo, un estudio reciente indica que la ivermectina es utilizada en potrillos y/o en adultos en el 96 % de los establecimientos equinos del centro y norte argentino con el uso generalizado (> 80 % de los establecimientos) de formulaciones inyectables bovinas pero administrada en forma oral a potrillos y equinos adultos (Cooper et al, 2021). Si bien esta forma de administración es utilizada desde hace tiempo en Argentina (Cerutti et al., 2012) y también en muchos otros países con distintos sistemas productivos equinos como por ejemplo Nueva Zelanda (Burrough, 1986); Sudáfrica (Matthee, 2003), Brasil (Martins et al., 2009), Polonia (Zak et al., 2017), Francia (Sallé et al., 2017) o Islandia (Martin et al., 2021), se desconoce la farmacocinética y la farmacodinamia de estas formulaciones inyectables bovinas cuando son administradas oralmente a los equinos y sus potenciales implicancias bajo el nuevo escenario que plantea la RA.
Las determinaciones sobre la actividad de los antihelmínticos en el campo y el conocimiento del status de susceptibilidad o resistencia son indispensables para el uso racional de los antihelmínticos. El método in vivo conocido como test de reducción en el conteo de huevos (TRCH) es actualmente el gold standard para determinar la eficacia clínica de las drogas nematodicidas en cualquier especie de hospedador. Además de la eficacia clínica de las drogas, en los pequeños estróngilos equinos el Período de Reaparición de Huevos (PRH) luego del tratamiento es de utilidad para detectar en forma temprana la presencia de fenómenos de resistencia (Nielsen et al., 2019). Un acortamiento del PRH es un indicador que estadios luminales de larvas de cuarto estadío (L4) pueden haber sobrevivido al tratamiento, madurado sexualmente y para luego oviponer, sugiriendo la presencia de RA (Nielsen et al., 2022a; Tzelos et al., 2017; von Samson-Himmelstjerna, 2012).
Los objetivos del presente trabajo fueron a) determinar la susceptibilidad o resistencia de los pequeños estróngilos a las lactonas macrocíclicas (mayormente ivermectina) contra los pequeños estróngilos bajo las condiciones de uso común en los establecimientos equinos del área central de la Argentina y b) evaluar si el PRH se encuentra en línea con lo documentado para estas drogas.
Materiales y métodos
-
Establecimientos y animales experimentales: En el período 2019 a 2021, la eficacia de la ivermectina y moxidectina sobre los pequeños estróngilos fue estudiada en 15 establecimientos de las provincias de Santa Fe (3), Córdoba (10), La Pampa (1) y Tucumán (1). Como animales experimentales se utilizaron inicialmente 334 equinos de 5 meses de edad hasta más de 20 años, de ambos sexos (incluyendo castrados y padrillos) y de diferentes biotipos y funciones por ejemplo trabajo, deporte, yeguas destinadas a transferencia de embriones o exposiciones ecuestres. El criterio siguiente para ser incluidos en el estudio fue contar en el día -1 o 0 de la experiencia con valores del número de huevos por gramo de heces (HPG) igual o superior a 150 y no haber recibido tratamiento antihelmíntico al menos en los últimos 60 días.
-
Tratamientos: todos los tratamientos se realizaron en forma oral por algunos de los autores del presente trabajo (Cooper LG; Paz Benard BJ) o por el personal veterinario, y respetando la formulación utilizada habitualmente en cada uno de los establecimientos. La ivermectina se administró como pastas equinas Eqvalan ® y Bagomectina equina ® o como soluciones inyectables para bovinos, ovinos y porcinos (Ivomec ®) y a la dosis mínima de 200 mcg/kg de peso vivo, mientras que la moxidectina se utilizó exclusivamente como pastas equinas (Trimox ®) a la dosis de 400 mcg/kg. El peso de los equinos se estimó en función de la longitud y el perímetro torácico de cada animal (Carroll et al.,1988) y a los fines del tratamiento y para evitar cualquier posibilidad de sub dosificación se adicionó 15 % al peso estimado.
-
Toma de muestras y técnicas coproparasitológicas: las muestras de materia fecal se obtuvieron por masaje rectal o recogiendo las mismas directamente del suelo en los casos en que se observó defecar en forma espontánea a los animales experimentales. El HPG se determinó utilizando la técnica de Mc Master modificada (detección mínima = 10 HPG) y alícuotas de las mismas muestras de materia fecal fueron utilizadas para cultivos coproparasitológicos mantenidos en incubadoras a 22-25ºC por 14 a 15 días. Las larvas obtenidas fueron recuperadas a través de un aparato de Baermann y clasificas de acuerdo a (Russell, 1948).
-
Determinaciones de eficacia y Período de Reaparición de Huevos: para determinar la eficacia clínica de la ivermectina se realizó el cálculo de la reducción en el conteo de huevos a las dos semanas posteriores al tratamiento, siguiendo las recientes recomendaciones de la World Association for the Advancement of Veterinary Parasitology (WAAVP) (Nielsen et al., 2022b) para la evaluación de antihelmínticos equinos en estudios de campo. La eficacia de la droga (adecuada, sospechosa o resistente) a nivel de establecimientos fue determinada usando la media del TRCH (%) y el límite inferior del intervalo de confianza (IC) de acuerdo a la Tabla 1.
En el día 35 post tratamiento, se realizó un nuevo TRCH para determinar si existía una reducción en el período de reaparición de huevos (PRH) en todos los equinos que se encontraron disponibles en ese día en el establecimiento (170 de un total de 192). El PRH es droga dependiente y en el caso de las lactonas macrocíclicas (y frente a poblaciones susceptibles) es actualmente superior a 6 a 8 semanas (Nielsen et al., 2019). Períodos más cortos indicarían la posibilidad de que se estén desarrollando fenómenos de resistencia. En el presente estudio se fijó al día 35 post tratamiento para establecer si este período estaba acortado. Brevemente y siguiendo la metodología sugerida recientemente por la World Association for the Advancement of Veterinary Parasitology (Nielsen et al., 2022b), se estableció un umbral basado en el 10 % menos del % del TRCH observado en el día 14 (Por ejemplo, TRCH día 14 = 99 %, umbral = 89 %). Luego si en el TRCH del día 35, el límite superior del intervalo de confianza resulto por debajo del umbral, se consideró como un PRH acortado. Anziani et al. (2017) informaron que el PRH de los pequeños estróngilos post tratamiento con ivermectina, puede estar influenciado por la edad de los animales y en este contexto en los 4 establecimientos que contaban con potrillos y adultos disponibles, los TRCHs de los días 14 y 35 se analizaron independientemente para cada categoría. Un resumen de los puntos a-d de esta sección de materiales y métodos es presentada en el diagrama de flujo de la Figura 1.
-
Análisis estadísticos: Los valores del número de huevos se sometieron a un análisis estadístico utilizando un paquete "eggCounts" en R específicamente diseñado (utilizando modelos jerárquicos bayesianos para datos de recuento de huevos fecales) que utiliza una estimación de la reducción media y 95 % de IC y una interfaz web (http://shiny.math.uzh.ch/user/furrer/shinyas/shiny-eggCounts/), que permite eliminar los errores de Poisson en la técnica de conteo (Nielsen et al., 2022b; Torgerson et al., 2014). El % del TRCH fue calculado para cada animal y las medias de los TRCHs, los IC al 95 % y las medias y rangos de los conteos de huevos pre y post tratamiento fueron también calculados para cada establecimiento. La eficacia general de la droga sin considerar los establecimientos individuales fue graficada utilizando el mismo modelo jerárquico bayesiano como la posterior distribución de las reducciones en el TRCH.

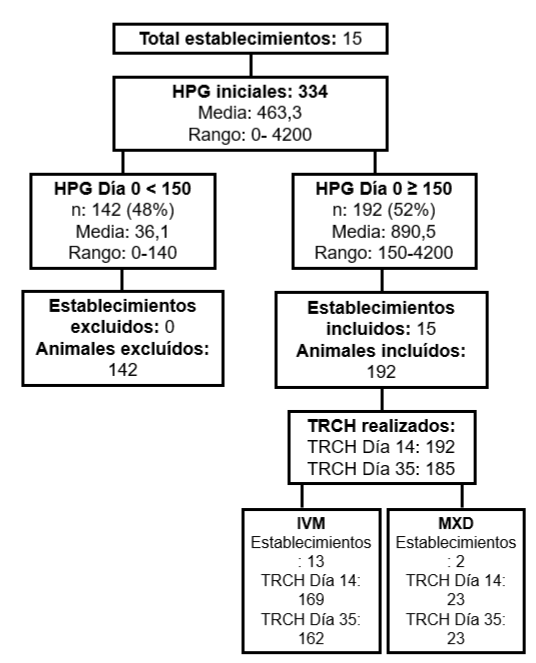
Figura 1
Diagrama de flujo en el que se observan la cantidad de establecimiento y de equinos, determinaciones coproparasitológicas realizadas y lactonas macrocíclicas empleadas en el estudio. IVM: Ivermectina. MXD: Moxidectina.
Resultados
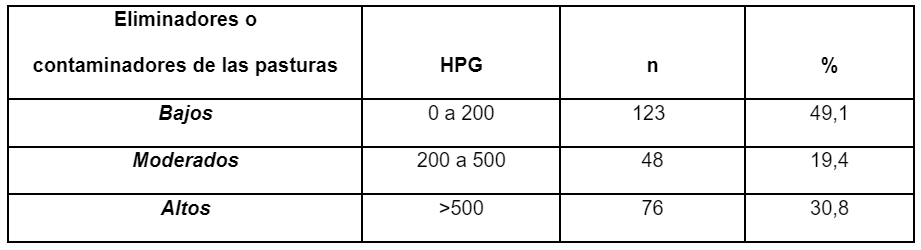
En el presente estudio la eliminación de huevos antes del tratamiento en los equinos adultos (n 247) fue sobredispersa o agregada y en línea con lo observado típicamente con este tipo de datos parasitológicos (Cooper et al., 2020). El rango en los valores del HPG fue de 0- 2120 y, de acuerdo a la eliminación de huevos antes del tratamiento, aproximadamente el 31% de los animales fueron considerados como altos eliminadores, el 19% como moderados y el 50% como bajos, considerando los puntos de corte tal como se lo expresa en la Tabla 2. En los coprocultivos realizados al pre-tratamiento más del 97% del total de las larvas obtenidas fueron clasificadas como pequeños estróngilos.
La eficacia de la ivermectina en el TRCH llevado a cabo luego de las dos semanas en todos los establecimientos osciló entre el 99,8 al 100 % (Tabla 3) y no se observaron diferencias entre las formulaciones (pasta o soluciones inyectable) administradas oralmente. La Tabla 4 muestra un resumen estadístico de cada variable y la Figura 2 presenta la información sobre los conteos de huevos pre y post tratamiento con ivermectina (pastas equinas o solución inyectable bovina per os) tal como fueron generados por el “eggCounts” package in R (http://www.math.uzh.ch/as/ estadísticasSummay statistics for each variable - generated using an index.php?id=eggCounts). Los dos establecimientos que utilizaron moxidectina lo hicieron con formulaciones equinas en pasta y en ambos se observaron eficacias del 100 % en el TRCH.
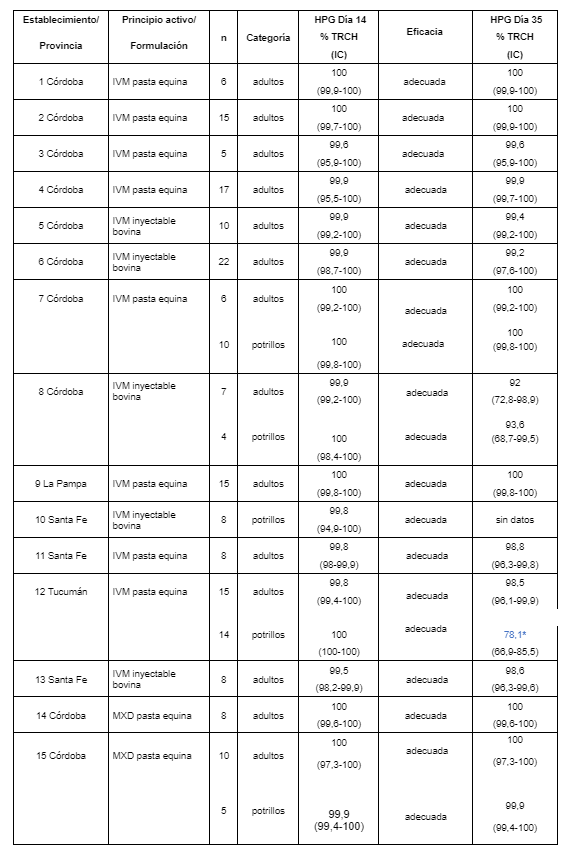
*PRH en la categoría potrillos fue menor a 6 semanas, sugiriendo poblaciones de pequeños estróngilos con menos susceptibilidad a la ivermectina.
Asimismo, el TRCH realizado sobre el día 35 para determinar si el PRH a ese día se encontraba acortado con ambas lactonas, tuvo un rango de eficacia del 94,2 al 100 % para la ivermectina (n 13) y del 100 % para la moxidectina (n 2). Del total de 192 equinos evaluados al día 14 post tratamiento, en 22 animales no se pudo realizar el TRCH en el día 35. En la Figura 3 (no incluye Moxidectina, n=2), se presentan los valores de la eficacia general de la ivermectina visualizada como la distribución posterior de la reducción del HPG al día 35 en los equinos tratados con ambas formulaciones empleando “eggCounts” package in R (http://www.math.uzh.ch/as/). En sólo uno de los establecimientos tratados con ivermectina (pastas equinas) se encontró un PRH acortado. En este establecimiento (12 Tucumán) y en la categoría de potrillos, el TRCH no se pudo realizar sobre el día 35 específicamente sino en el día 39 postratamiento y el % de reducción para este día fue de 78,1 con un IC al 95 % de 66,8 y 85,5. La eficacia de la droga en los potrillos de este establecimiento en particular, fue a los 14 días post tratamiento del 100 % pero en el día 39 del mismo (Figura 4), el total de los 14 animales que componían este grupo ya eliminaba huevos en la materia fecal (media aritmética: 251,4 y rango: 80-600).

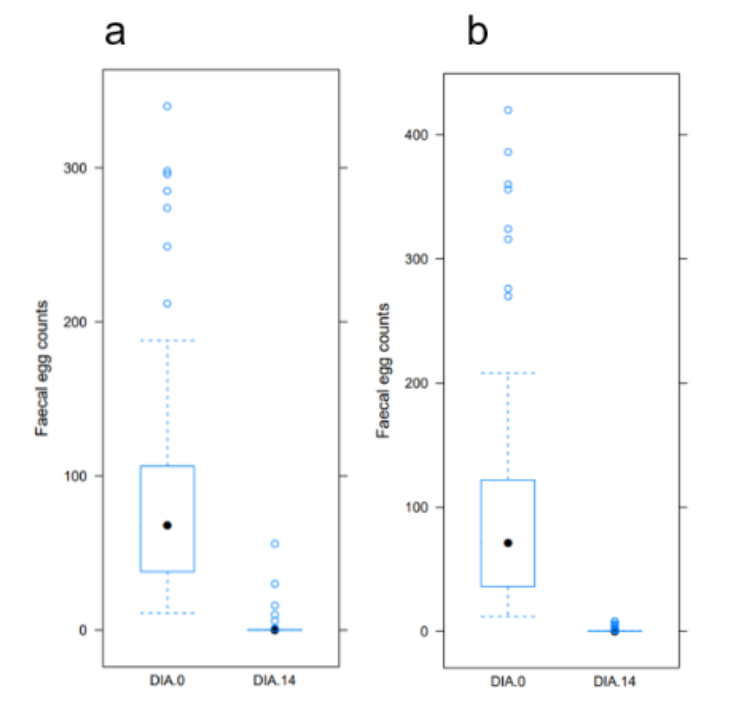
Figura 2.
Información sobre los valores del HPG pre y post tratamiento en 156 equinos de 15 establecimientos tratados con ivermectina empleando: a) pastas equinas (n= 97) o b) soluciones inyectables bovinas per os (n= 59).
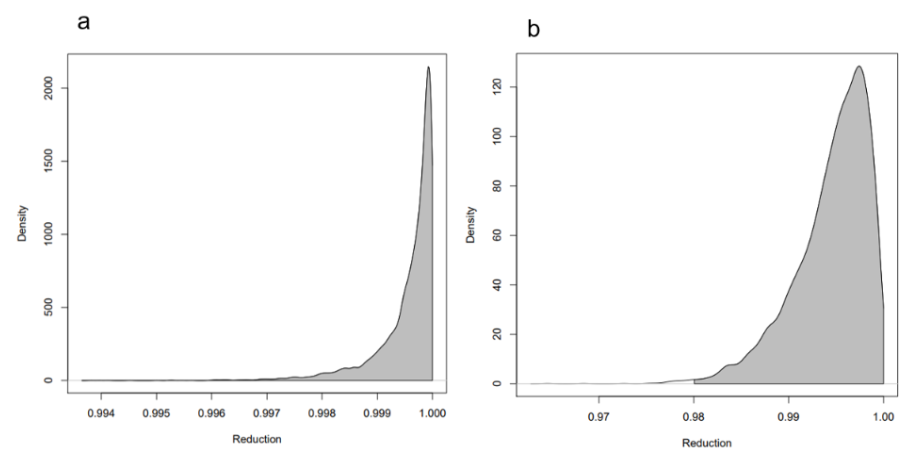
Figura 3.
Probabilidad de la distribución posterior de las reducciones en los TRCHs llevados a cabo en los equinos tratados con Ivermectina en el día 35 post tratamiento empleando a) pasta equinas y b) soluciones bovinas inyectables per os.
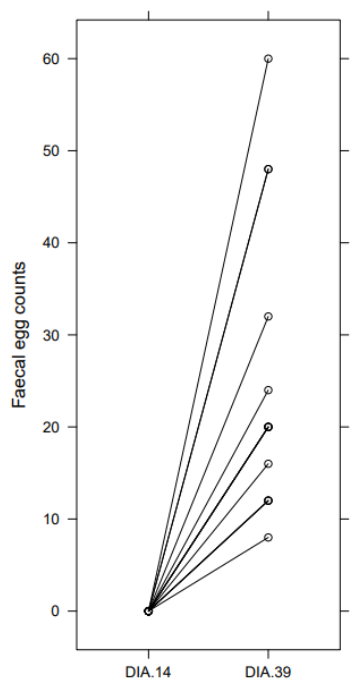
Figura 4.
Establecimiento 12 Tucumán. Categoría potrillos. HPG observado en el día 14 y día 39 post tratamiento con Ivermectina formulación equina en pasta (TRCH 78,1%) y donde cada punto es el valor del HPG en cada uno de los potrillos.
Discusión
En el contexto actual de aumento de la RA en los nematodos equinos, es necesario el monitoreo permanente sobre la eficacia actual que están logrando las drogas en el campo para identificar fallas tempranas, cambiar prácticas de control y preservar la vida útil de los antihelmínticos a nivel de establecimientos o a escala regional. Esto es de particular interés en todo el mundo ya que no existen antihelmínticos equinos con nuevos modos de acción desde la introducción de la ivermectina al mercado veterinario mundial hace aproximadamente 40 años (Becher et al, 2018). En la Argentina esta droga es masivamente utilizada anualmente en todas las categorías equinas (Cooper et al., 2021), pero la eficacia de las mismas bajo las condiciones actuales de uso, es notoriamente escasa y restringida a observaciones en establecimientos puntuales. Así, por ejemplo, Anziani et al. (2017) informaron una eficacia del 100% observada a las dos semanas post tratamiento en Santa Fe y Córdoba y más recientemente, similares resultados fueron documentados en dos establecimientos del sudeste de la provincia de Buenos Aires (Perdomo et al., 2019; Saumell et al., 2017). El presente estudio, respetando las prácticas que estaban utilizando los productores de equinos en el uso de ivermectina o moxidectina, tuvo un alcance regional involucrando a 192 equinos de ambos sexos y diferentes edades pertenecientes a 15 establecimientos del área central de la Argentina y los resultados confirman la alta eficacia clínica de ambas. Resultados similares a los nuestros han sido informados en la mayoría de los países del mundo y muestran ausencia de signos clínicos de resistencia con eficacias altas de las lactonas macrocíclicas (entre el 99,5 y 100 %) a las dos semanas post tratamiento. Algunos de estos estudios incluyen, por ejemplo: EEUU (Kaplan, 2002; Nielsen et al., 2018); Canadá (Butler et al., 2021); Holanda (van Doorn et al., 2012); Reino Unido (Matthews, 2014); Italia y Alemania (Traversa et al., 2009); Francia (Sallé et al., 2017); Australia(Morris et al., 2019); Nueva Zelanda (Rosanowski et al., 2017); Lituania (Dauparaitė et al., 2021) y Polonia (Zak et al., 2017). En nuestro trabajo se utilizó un modelo jerárquico Bayesiano recientemente sugerido por la WAAVP para medir la eficacia antihelmíntica en equinos bajo condiciones de campo (Nielsen et al., 2022b) y que ha sido empleado recientemente en esta especie (Butler et al., 2021; Geurden et al., 2014; Nielsen et al., 2020). Estos modelos estiman la media y los IC teniendo en cuenta la variabilidad y particular distribución de los huevos en los animales o dentro de la muestra para calcular las reducciones en el TRCH, la probabilidad de las reducciones luego del tratamiento y los IC (Torgerson et al., 2014). El umbral para clasificar el status de susceptibilidad o resistencia es similar a los anteriores (Coles et al., 1992), pero permitiendo análisis estadísticos más robustos (Nielsen, et al., 2022b).
En el presente trabajo debería considerarse que es improbable que los 15 establecimientos estudiados sean representativos del status de susceptibilidad a las lactonas en todos los equinos de la región y hay un potencial sesgo en la selección de los mismos que puede estar influenciando estos resultados. Esta limitante en el tamaño de la muestra es consecuencia de incluir solamente establecimientos dispuestos a participar en el estudio y a la practibilidad o dificultades para evaluar un número mayor de establecimientos bajo las condiciones que requieren estos métodos in vivo. No obstante, estos condicionamientos y limitaciones son comunes a los estudios citados precedentemente y que muestran ausencia de signos clínicos de resistencia con eficacias altas de las lactonas macrocíclicas (entre el 99,5 y 100 %) a las dos semanas post tratamiento, Es notable que las lactonas, y muy especialmente la ivermectina, continúen con eficacias superiores al 99 % ya que fueron, y por lejos, las drogas más utilizadas en todos estos países (incluida la Argentina) durante varias décadas previas a estos reportes (Becher et al., 2018; Cooper et al., 2021). Por otra parte, existen también en la literatura algunos informes en establecimientos puntuales sobre eficacia subóptima o disminuida de las lactonas macrocíclicas a través de la reducción en el conteo de huevos a las dos semanas posteriores a la implementación de los tratamientos (Canever et al., 2013; Molento et al., 2012; Traversa et al., 2009) sugiriendo fenómenos de resistencia. Sin embargo, los estudios más consistentes, con eficacia clínica disminuida post administración de lactonas y con re-tratamiento de animales mostrando en forma conclusiva la RA de pequeños estróngilos a este grupo químico han sido informados muy recientemente en dos estudios en EEUU con ivermectina y moxidectina (Nielsen et al., 2020; (Nielsen, et al., 2022a) y un tercero en Australia (Abbas et al., 2021) con moxidectina y abamectina. Los tres trabajos se realizaron siempre sobre animales jóvenes y se desconocen hallazgos similares en otras categorías de equinos. En ambos estudios de EEUU, el status de resistencia no pudo ser comprobado en un número importante de animales adultos (yeguas madres) de los mismos establecimientos y en el caso australiano, los estudios incluyeron únicamente animales jóvenes. Actualmente se desconoce si diferencias inmunológicas, fisiológicas o la presencia de diferentes especies de ciatostomas pueden influenciar la eficacia de la droga en las diferentes categorías equinas (Nielsen, et al., 2022a).
Con respecto al PRH como una alerta temprano al desarrollo de RA en los pequeños estróngilos equinos, la información es mayor a las documentadas sobre fallas de la eficacia clínica para controlar la oviposición de los nematodos adultos. Como se expresara anteriormente, un acortamiento del PRH es un indicador que larvas de cuarto estadío (L4) pueden haber sobrevivido al tratamiento, madurado sexualmente y completar su oviposición. Este PRH es droga dependiente y para las lactonas (y en ausencia de RA) es considerado actualmente mayor a las 6 a 8 semanas para la ivermectina y de 10 a 12 semanas para la moxidectina (AAVP 2019). Indicaciones de un período acortado con ambas drogas han sido informados en Alemania (von Samson-Himmelstjerna et al., 2007), Reino Unido (Relf et al., 2014), EEUU (Lyons et al., 2008), Francia (Sallé et al., 2017) o Bélgica, Holanda e Italia (Geurden et al., 2014). Sin embargo, es muy difícil la extrapolación de los resultados entre la mayoría de estos estudios por la carencia de parámetros científicos comunes para su determinación ya que hasta el 2022 no existía un protocolo para determinar el PRH (Nielsen, et al., 2022b). Así, algunos estudios consideraban como PRH a la semana post tratamiento en que se observaba la presencia de los primeros huevos (Little et al., 2003; Lyons et al.; 2008, Lyons et al., 2011). Otros autores utilizaron umbrales fijos de 100 o 200 huevos para definir este PRH (Boersema et al., 1996; Mercier et al., 2001) o realizaban TRCHs semanales para calcular eficacias y luego establecían un umbral (< 90 %) para fijar la semana en que se alcanzaba este cut off (von Samson-Himmelstjerna et al., 2007). Obviamente los resultados obtenidos con estos diferentes métodos fueron muy difíciles de comparar y la nueva guía de la WAAVP para evaluar el PRH en las pruebas sobre eficacia de antihelmínticos equinos (Nielsen et al., 2022b) es una aproximación a la solución de esta situación. El modelo jerárquico Bayesiano utilizado en este estudio para el análisis de los TRCHs tuvo en cuenta la variabilidad de la distribución de los huevos entre animales para calcular las reducciones, la probabilidad de las reducciones luego del tratamiento y los IC (Nielsen et al., 2022b; Torgerson et al., 2014). En nuestro trabajo utilizando este protocolo solo detectamos un establecimiento en los que se sospecha de un acortamiento de este período y podría estar indicando el desarrollo incipiente de poblaciones con menor susceptibilidad a la ivermectina. Por razones de practicidad y al igual que en otros estudios (Sallé et al., 2017) nuestro estudio evaluó si el PRH se encontraba acortado solo en la semana 5 post tratamiento con lactonas, lo cual puede resultar conservador y muy especialmente en el caso de la moxidectina la cual se caracteriza por PRH mayores a la ivermectina.
En la producción equina de la Argentina hay un uso llamativamente alto de formulaciones de ivermectina que no se encuentran registradas específicamente para los equinos (soluciones inyectables bovinas administradas oralmente). La administración fuera de marbete es una prerrogativa del veterinario para ser utilizada bajo condiciones precisas, pero en los productores de equinos de nuestro país este tipo de uso (especialmente en grandes criadores) parece ser la norma y no la excepción (Cooper et al., 2021). Se desconocen la farmacocinética y farmacodinamia de la droga bajo estas condiciones de uso y son necesarios estudios específicos para determinar la eficacia comparativa y sus potenciales implicancias. Dicho esto, y bajo las condiciones y limitantes de nuestro estudio, no se pudo establecer diferencias aparentes en la eficacia clínica entre ambas formulaciones luego de la administración oral en los TRCHs (día 14 y día 35 post tratamiento). En cada establecimiento los tratamientos se realizaron con una u otra alternativa y la eficacia comparativa podría estar influenciada por la diversidad o la abundancia de especies de los pequeños estróngilos que se encontraban presentes en los mismos. Sin embargo, resultados similares de eficacia (100 %) y de disponibilidad plasmática de la droga fueron informados en nuestro país por Saumell et al. (2017) comparando formulaciones de ivermectina en pasta o inyectables pero administradas por boca en equinos de un mismo establecimiento. Otra limitante adicional a considerar, es el PRH de nuestro estudio ya que el mismo se estableció sólo durante la quinta semana y se desconoce si ambas formulaciones podrían haberse comportado igual en las semanas posteriores y por lo tanto se hacen necesarios estudios futuros para clarificar esta situación.
En el escenario que plantea la RA y considerando la ausencia en el futuro cercano de nuevas drogas para los equinos, es imperativo preservar la actividad y mantener la vida útil de aquellas que aún muestran una eficacia adecuada como las lactonas macrocíclicas. En el hemisferio norte, los programas de control basados en consensos de expertos y guías para las buenas prácticas (ESCCAP, 2018; Nielsen et al., 2019) están promoviendo la sustitución de los tratamientos masivos por aplicación de tratamientos selectivos de antihelmínticos (TS) solamente a los equinos con valores del HPG considerados como moderados o altos eliminadores de huevos o contaminadores de las pasturas (HPG 200 a 500 y HPG ≥500 respectivamente). Esto resulta en reducciones en el uso de antihelmíntico mayores al 60 % en los equinos, disminución en la presión de selección sobre el genoma parasitario y aumento de las poblaciones en refugio en las pasturas para demorar el desarrollo de resistencia. Al inicio del presente estudio, los equinos considerados como altos eliminadores comprendían el 30,8%, lo cual concuerda con resultados similares en estudios previos de nuestro país (Cooper et al., 2020) y enfatiza también la factibilidad de esta alternativa de control en países como el nuestro. La implementación de estos TS requerirá de un importante esfuerzo en la educación y extensión a veterinarios y productores, pero la sustentabilidad del control químico depende del uso más racional y selectivo de los antihelmínticos y el momento para empezar es ahora cuando todavía disponemos de moléculas como la ivermectina y moxidectina que ameritan ser preservadas. Sin embargo y a la luz de los recientes informes sobre RA a la ivermectina en EEUU y Australia, es altamente probable que esta situación pueda modificarse y otros diagnósticos similares comiencen a extenderse y ser más frecuentes en el mundo (Nielsen et al., 2020). El gran movimiento que caracteriza a la industria equina y sus eventos ecuestres podría permitir (como ya ha sido documentada entre Irlanda y EEUU) importar animales portando parásitos con genes resistentes y favorecer la distribución de la RA entre continentes (Nielsen et al., 2020). En nuestro país, es habitual y constante el traslado de equinos a lo largo de todo el país, dentro de las provincias y entre regiones. Regularmente se trasladan con fines reproductivos, eventos o competencias deportivas; y en otras ocasiones por cuestiones estacionales, de pastoreo, descanso o simplemente razones comerciales. En este contexto, equinos de diferentes orígenes pueden compartir pasturas favoreciendo la transmisión y la distribución de parásitos portadores de genes resistentes (Kaplan, 2002).
Tomados en conjunto, los resultados del presente estudio indican que en el área central de la Argentina las lactonas macrocíclicas (al igual que en la mayor parte del mundo) permanecen con una eficacia excelente para el control de los pequeños estróngilos equinos. No obstante, el desarrollo de potenciales fenómenos de resistencia podría estar lentamente surgiendo en las poblaciones locales de estos nematodos en función de menores PRH como el descripto en uno de los establecimientos del presente trabajo. La eficacia clínica actual sobre los estadíos adultos y considerada como supresión de la oviposición a los 14 días post tratamiento aparentemente no fue modificada con las administraciones de las formulaciones como pastas o soluciones. No obstante, se requiere de mayor información y estudios adicionales sobre el potencial impacto en el PRH de estas formas de administración. En las condiciones de la Argentina, la alta eficacia actual de la ivermectina amerita un uso más racional de la misma si se quiere mantener la sustentabilidad del control químico suplantando su uso masivo por un uso selectivo de la misma.
Bibliografía
Abbas G, Ghafar A, Hurley J, Bauquier J, Beasley A, Wilkes EJA, Jacobson C, El-Hage C, Cudmore L, Carrigan P, Tennent-Brown B, Gauci CG, Nielsen MK, Hughes KJ, Beveridge I, Jabbar A. 2021. Cyathostomin resistance to moxidectin and combinations of anthelmintics in Australian horses. Parasites Vectors 14.
Anziani O, Ardusso G. 2017. Resistencia a los antihelmínticos en nematodos intestinales que parasitan a los equinos en la Argentina. RIA 43: 1-12.
Anziani O, Catanzaritti H. 2005. Resistencia de los pequeños estrongílidos (grupo ciatostoma) a los bencimidazoles en equinos del área central de Argentina. Vet. Arg. 218: 571-578.
Anziani O, Muchiut S, Cooper L, Cerutti J. 2016. Small strongyles (cyathostomes) and benzimidazoles. Persistance of status of resistance after nine years without the use of these drugs and efficacy of ivermectin about this parasite population. J. Equine Vet. Sci. 39: S52-S53.
Anziani OS, Cooper LG, Cerutti J, Fassola L, Torrents J, Masnyj F, Caffe G. 2017. Pequeños estróngilos de los equinos. Eficacia clínica y periodo de reaparición de huevos luego del tratamiento con moxidectina y pirantel. FAVE Cs. Vet. 16: 83-87.
Becher AM, van Doorn DC, Pfister K, Kaplan RM, Reist M, Nielsen MK. 2018. Equine parasite control and the role of national legislation - A multinational questionnaire survey. Vet. Parasitol. 259: 6-12.
Boersema JH, Eysker M, Maas J, van der Aar WM. 1996. Comparison of the reappearance of strongyle eggs in foals, yearlings, and adult horses after treatment with ivermectin or pyrantel. Vet Q. 18: 7-9.
Burrough S. 1986. Ivermectin toxicity in horses. N. Z. Vet. J. 34: 137-138.
Butler AJ, Greenbank H, Parrish R, Nielsen MK, Stoughton WB. 2021. Prevalence of anthelmintic resistant cyathostomins in Prince Edward Island, Canada. Vet. Parasitol. Reg. Stud. Reports 26.
Canever RJ, Braga PRC, Boeckh A, Grycajuck M, Bier D, Molento MB. 2013. Lack of Cyathostomin sp. reduction after anthelmintic treatment in horses in Brazil. Vet. Parasitol. 194: 35-39.
Carroll, C., & Huntington, P. (1988). Body condition scoring and weight estimation of horses. J. Equine Vet. Sci. 20: 41-45.
Cerutti J, Cooper L, Caffe G, Cervilla N, Muchiut S, Anziani O. 2012. Resistencia de los pequeños estrongílidos (grupo ciatostoma) a los bencimidazoles en equinos del área central de Argentina. InVet 14: 41-46.
Coles, GC, Bauer C, Borgsteede FHM, Geerts S, Klei TR, Taylor MA, Waller PJ, Borgsteede C, Geerts F. HM, Klei S, Taylor TR, Waller MA. 1992. World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) methods for the detection of anthelmintic resistance in nematodos of veterinary importance. Vet. Parasitol. 44: 35-44.
Cooper LG, Paz Benard BJ, Molineri A, Caffe G, Fernández Llanos I, Fassola LA, Cerutti J, Anziani OS. 2020. Eliminación de huevos de los pequeños estróngilos en la materia fecal de los equinos y su importancia práctica en la posibilidad de tratamientos selectivos. FAVE Cs. Vet. 19: 1-6.
Cooper LG, Paz Benard BJ, Nielsen MK, Molineri A, Anziani OS. 2021. A survey of helminth control practices on large horse farms in Argentina. Equine Vet. J. 53: 50-50.
Dauparaitė E, Kupčinskas T, von Samson-Himmelstjerna G, Petkevičius, S. 2021. Anthelmintic resistance of horse strongyle nematodos to ivermectin and pyrantel in Lithuania. Acta Vet. 63.
ESCCAP. 2018. Guía para el tratamiento y control de las infecciones por parásitos gastrointestinales de los équidos 8.
Geurden T, van Doorn D, Claerebout E, Kooyman F, de Keersmaecker S, Vercruysse J, Besognet B, Vanimisetti B, di Regalbono AF, Beraldo P, di Cesare A, Traversa D. 2014. Decreased strongyle egg re-appearance period after treatment with ivermectin and moxidectin in horses in Belgium, Italy and The Netherlands. Vet. Parasitol. 204: 291-296.
Kaplan RM. 2002. La résistance aux anthelmintiques chez les nématodes des chevaux. Vet. Res. 33: 491-507.
Kaplan RM, Klei TR, Lyons ET, Lester G, Courtney CH, French DD, Tolliver SC, Vidyashankar AN, & Zhao Y. 2004. Prevalence of anthelmintic resistant cyathostomes on horse farms. JAVMA 225: 903-910.
Little D, Flowers JR, Hammerberg BH, Gardner SY. 2003. Management of drug-resistant cyathostominosis on a breeding farm in central North Carolina. Equine Vet. J. 35: 246-251.
Lyons ET, Tolliver SC, Collins SS, Ionita M, Kuzmina TA, Rossano M. 2011. Field tests demonstrating reduced activity of ivermectin and moxidectin against small strongyles in horses on 14 farms in Central Kentucky in 2007-2009. Parasitol. Res. 108: 355-360.
Lyons ET, Tolliver SC, Ionita M, Lewellen A, Collins SS. 2008. Field studies indicating reduced activity of ivermectin on small strongyles in horses on a farm in Central Kentucky. Parasitol. Res. 103: 209-215.
Martin F, Svansson V, Eydal M, Oddsdóttir C, Ernback M, Persson I, Tydén E. 2021. First Report of Resistance to Ivermectin in Parascaris univalens in Iceland. J. Parasitol. 107: 16-22.
Martins I, Verocai G, Correia T, Melo R, Pereira M J, Scott F, Grisi L. 2009. Survey on control and management practices of equine helminthes infection. Pesq. Vet. Bras. 29: 253-257.
Matthee, S. 2003. Anthelmintic treatment in horses: the extra-label use of products and the danger of under-dosing. J. S. Afr. Vet.Ass. 74: 53-56.
Matthews, JB. 2014. Anthelmintic resistance in equine nematodos. Int. J. Parasitol-Drug. 4: 310-315.
Mercier P, Chick B, Alves-Branco F, White CR. 2001. Comparative efficacy, persistent effect, and treatment intervals of anthelmintic pastes in naturally infected horses. Vet. Parasitol. 99: 29-39.
Molento MB, Nielsen MK, Kaplan RM. 2012. Resistance to avermectin/milbemycin anthelmintics in equine cyathostomins - Current situation. Vet. Parasitol. 185: 16-24.
Morris LH, Colgan S, Leathwick DM, Nielsen MK. 2019. Anthelmintic efficacy of single active and combination products against commonly occurring parasites in foals. Vet. Parasitol. 268: 46-52.
Nielsen MK, Banahan M, Kaplan RM. 2020. Importation of macrocyclic lactone resistant cyathostomins on a US thoroughbred farm. Int. J. Parasitol. - Drug. 14: 99-104.
Nielsen MK, Branan MA, Wiedenheft AM, Digianantonio R, Scare JA, Bellaw JL, Garber LP, Kopral CA, Phillippi-Taylor AM, Traub-Dargatz JL. 2018. Anthelmintic efficacy against equine strongyles in the United States. Vet. Parasitol. 259: 53-60.
Nielsen MK, Littman BA, Orzech SW, Ripley NE. 2022. Equine strongylids: Ivermectin efficacy and fecal egg shedding patterns. Parasitol. Res. 121: 1691-1697.
Nielsen MK, Mittel L, Grice A, Erskine M, Graves E, Vaala W, Tully RC, French DD, Bowman R, Kaplan RM. 2019. AAEP Internal Parasite Control Guidelines.1-25. https://aaep.org/
Nielsen MK, Reinemeyer CR, Donecker JM, Leathwick DM, Marchiondo AA, Kaplan RM. 2014. Anthelmintic resistance in equine parasites-Current evidence and knowledge gaps. Vet. Parasitol. 204: 55-63.
Nielsen MK, von Samson-Himmelstjerna G, Kuzmina TA, van Doorn DCK, Meana A, Rehbein S, Elliott T, Reinemeyer CR. 2022. World association for the advancement of veterinary parasitology (WAAVP): Third edition of guideline for evaluating the efficacy of equine anthelmintics. Vet. Parasitol. 303.
Perdomo R, Cantón G, Fiel C. 2019. Evaluación de la resistencia antihelmíntica en equinos en un establecimiento de la Provincia de Buenos Aires. Universidad Nacional del Centro.
Relf VE, Lester HE, Morgan ER, Hodgkinson JE, Matthews JB. 2014. Anthelmintic efficacy on UK Thoroughbred stud farms. Parasitol. Int. 44: 507-514.
Rosanowski SM, Bolwell CF, Scott I, Sells PD, Rogers CW. 2017. The efficacy of Ivermectin against strongyles in yearlings on Thoroughbred breeding farms in New Zealand. Vet. Parasitol. Reg. Stud. Reports 8: 70-74.
Russell, A. 1948. The development of helminthiasis in thoroughbred foals. J. Comp. Pathol. 58: 107-127.
Sallé G, Cortet J, Bois I, Dubès C, Guyot-Sionest Q, Larrieu C, Landrin V, Majorel G, Wittreck S, Woringer E, Couroucé A, Guillot J, Jacquiet P, Guégnard F, Blanchard A, Leblond A. 2017. Risk factor analysis of equine strongyle resistance to anthelmintics. Int. J. Parasitol. -Drug. 7: 407-415.
Sallé G, Cortet J, Koch C, Reigner F, Cabaret J. 2015. Economic assessment of FEC-based targeted selective drenching in horses. Vet. Parasitol. 214: 159-166.
Saumell C, Lifschitz A, Baroni R, Fusé L, Bistoletti M, Sagües F, Bruno S, Alvarez G, Lanusse C, Alvarez L. 2017. The route of administration drastically affects ivermectin activity against small strongyles in horses. Vet. Parasitol. 236: 62-67.
Scott I, Bishop RM, Pomroy WE. 2015. Anthelmintic resistance in equine helminth parasites - a growing issue for horse owners and veterinarians in New Zealand? J. N. Z. Vet. 63: 188-198. Taylor and Francis Ltd.
Torgerson PR, Paul M, Furrer R. 2014. Evaluating faecal egg count reduction using a specifically designed package “eggCounts” in R and a user-friendly web interface. Int. J. Parasitol. 44: 299-303.
Traversa D, von Samson-Himmelstjerna G, Demeler J, Milillo P, Schürmann S, Barnes H, Otranto D, Perrucci S, di Regalbono AF, Beraldo P, Boeckh A, Cobb R. 2009. Anthelmintic resistance in cyathostomin populations from horse yards in Italy, Unitedve Kingdom and Germany. Parasites Vectors 2.
Tzelos T, Barbeito JSG, Nielsen MK, Morgan ER, Hodgkinson JE, Matthews JB. 2017. Strongyle egg reappearance period after moxidectin treatment and its relationship with management factors in UK equine populations. Vet. Parasitol. 237: 70-76.
van Doorn, D. C. K., Eysker, M., Kooyman, F. N. J., Wagenaar, J. A., & Ploeger, H. W. (2012). Searching for ivermectin resistance in Dutch horses. Vet. Parasitol. 185: 355-358.
von Samson-Himmelstjerna G. 2012. Anthelmintic resistance in equine parasites - detection, potential clinical relevance and implications for control. Vet. Parasitol. 185: 2-8.
von Samson-Himmelstjerna G, Fritzen B, Demeler J, Schürmann S, Rohn K, Schnieder T, Epe C. 2007. Cases of reduced cyathostomin egg-reappearance period and failure of Parascaris equorum egg count reduction following ivermectin treatment as well as survey on pyrantel efficacy on German horse farms. Vet. Parasitol. 144: 74-80.
Wilkes EJA, Heller J, Raidal SL, Woodgate RG, Hughes KJ. 2020. A questionnaire study of parasite control in Thoroughbred and Standardbred horses in Australia. Equine Vet. J. 52: 547-555.
Zak A, Siwinska N, Slowikowska M, Borowicz H, Kubiak K, Hildebrand J, Popiolek M, Niedzwiedz A 2017. Searching for ivermectin resistance in a Strongylidae population of horses stabled in Poland. BMC Vet. Res. 13.